
Isoamylacetatstruktur, egenskaper, syntese og bruksområder
De isoamylacetat er en ester hvis molekylformel er CH3COO (CHto)toCH (CH3)to. Ved romtemperatur består den av en fet, klar, fargeløs, brennbar og flyktig væske. Faktisk er det for ustabilt og duftende.
Hovedkarakteristikken er å avgi en lukt som bidrar til aromaen til mange frukter, spesielt de fra banan. På samme måte utgjør denne siste frukten en av dens naturlige kilder..

Derav navnet på bananolje som blir gitt til en løsning av isoamylacetat, eller til en blanding av isomylacetat med nitrocellulose. Forbindelsen er mye brukt som smakstilsetning for mat, is og godteri.
I tillegg brukes den til produksjon av dufter med forskjellige bruksområder. Det er også et løsningsmiddel som brukes i ekstraksjon av metaller og organiske forbindelser som eddiksyre..
Isoamylacetat er resultatet av forestring av isoamylalkohol med eddiksyre. I organiske kjemiundervisningslaboratorier representerer denne syntesen en interessant opplevelse å implementere forestring, mens den flommer over laboratoriet med bananduft.
Artikkelindeks
- 1 Struktur av isoamylacetat
- 1.1 Intermolekylære interaksjoner
- 1.2 Banan duft
- 2 eiendommer
- 2.1 Kjemiske navn
- 2.2 Molekylformel
- 2.3 Molekylvekt
- 2.4 Fysisk beskrivelse
- 2,5 Lukt
- 2.6 Smak
- 2.7 Kokepunkt
- 2.8 Smeltepunkt
- 2.9 Flammepunkt
- 2.10 Løselighet i vann
- 2.11 Løselighet i organiske løsningsmidler
- 2.12 Tetthet
- 2.13 Damptetthet
- 2.14 Damptrykk
- 2.15 Selvantennelsestemperatur
- 2.16 Viskositet
- 2.17 Forbrenningsvarme
- 2.18 Luktterskel
- 2.19 Brytningsindeks
- 2,20 Relativ fordampningshastighet
- 2.21 Dielektrisk konstant
- 2.22 Oppbevaring
- 3 Syntese
- 4 bruksområder
- 4.1 Mat og drikke smaksstoffer
- 4.2 Løsemiddel og fortynningsmiddel
- 4.3 Dufter
- 4.4 Andre
- 5 risikoer
- 6 Referanser
Struktur av isoamylacetat
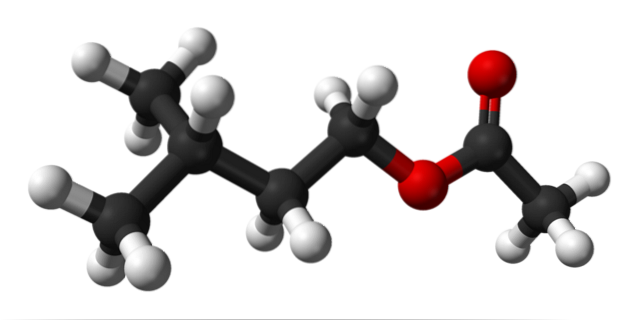
Det øvre bildet viser den molekylære strukturen til isoamylacetat ved bruk av en sfærer og stangmodell. De røde kulene tilsvarer oksygenatomer, spesielt de som identifiserer denne forbindelsen som en ester; dens eterdel, R-O-R, og karbonylgruppen, C = O, og deretter ha strukturformelen R'COOR.
Til venstre, R', vi har isopentylalkylgruppen, (CH3)toCHCHtoCHto; og til høyre R, til metylgruppen, som 'acetatet' med navnet på denne esteren skyldes. Det er en relativt liten ester som er i stand til å samhandle med de kjemiske reseptorene i nesen, og forårsake signaler om at hjernen tolker som duft..
Intermolekylære interaksjoner
Selve isoamylacetatmolekylet er fleksibelt; men isopentylradikalen har ikke fordeler med intermolekylære interaksjoner fordi den er forgrenet og sterkt hindrer oksygenatomer i å samhandle effektivt gjennom dipol-dipolkrefter.
Disse to oksygenet kan heller ikke akseptere hydrogenbindinger; strukturelt har molekylet ingen måte å donere dem på. I motsetning til de avbrutte dipolene kan isoamylacetat samhandle intermolekylært ved hjelp av London-dispersjonskrefter; som er direkte proporsjonale med deres molekylære masse.
Dermed er det molekylmassen til esteren som er ansvarlig for at molekylene danner en væske med høyt kokepunkt (141 ° C). På samme måte er det ansvarlig for at det smelter fast ved en temperatur på -78 ° C.
Banan duft
Dens intermolekylære krefter er så svake at væsken er flyktig nok til å gjennomsyre omgivelsene med bananlukt. Interessant, den søte lukten av denne esteren kan endres hvis antall karbon reduseres eller økes..
Det vil si at hvis den i stedet for å ha seks alifatiske karboner hadde fem (med isobutylradikalen), ville lukten ligne på bringebær; hvis radikalet var sekbutyl, ville lukten være fylt med spor av organiske løsningsmidler; og hvis den hadde mer enn seks karbonatomer, ville lukten begynne å bli såpende og metallisk.
Eiendommer
Kjemiske navn
-Isoamylacetat
-Isopentyletanoat
-3-metylbutylacetat
-Isopentylacetat
-Banan- eller plantainolje.
Molekylær formel
C7H14ELLERto eller CH3COO (CHto)toCH (CH3)to
Molekylær vekt
130,187 g / mol.
Fysisk beskrivelse
Det er en fet, klar og fargeløs væske.
Lukt
Ved romtemperatur har den en intens og behagelig bananlukt.
Smak
Den har en smak som ligner på pære og eple.
Kokepunkt
124,5 ºC.
Smeltepunkt
-78,5 ºC.
antennelsespunkt
Lukket kopp 33ºC; åpen kopp 38ºC.
Vannløselighet
2000 mg / l ved 25 ºC.
Løselighet i organiske løsningsmidler
Blandbar med alkohol, eter, etylacetat og amylalkohol.
Tetthet
0,876 g / cm3.
Damptetthet
4,49 (i forhold til luft = 1).
Damptrykk
5,6 mmHg ved 25 ºC.
Selvantennelsestemperatur
360 ºF (680 ºF).
Viskositet
-1,03 cPoise ved 8,97 ° C
-0,872 cPoise ved 19,91 ° C.
Forbrenningsvarme
8.000 cal / g.
Luktterskel
Luft = 0,025 µL / L
Vann = 0,017 mg / L.
Brytningsindeks
1400 ved 20 ºC.
Relativ fordampningshastighet
0,42 (i forhold til butylacetat = 1).
Dialektrisk konstant
4,72 ved 20 ºC.
Oppbevaring
Isoamylacetat er en flyktig og brennbar forbindelse. Derfor bør den oppbevares kaldt i helt lufttette beholdere, borte fra brennbare stoffer..
Syntese
Den produseres ved forestring av isoamylalkohol med iseddik, i en prosess kjent som Fishers forestring. Svovelsyre brukes ofte som katalysator, men p-toluensulfonsyre katalyserer også reaksjonen:
(CH3)toCH-CHto-CHtoCHtoOH + CH3COOH => CH3COOCHto-CHto-CHto-CH (CH3)to
applikasjoner
Mat og drikke smaksstoffer
Den brukes til å formidle en pæresmak i vann og i sirup. Den brukes i Kina til å tilberede fruktsmaker, som jordbær, bjørnebær, ananas, pære, eple, drue og banan. Dosene som brukes er: 190 mg / kg i konfekt; 120 mg / kg i bakverk; 56 mg / kg i iskrem; og 28 mg / kg i brus.
Løsemiddel og tynnere
Det er et løsemiddel for:
-Nitrocellulose og celluloid
-Vanntette lakker
-Ester tyggegummi
-Vinylharpiks
-Coumarone harpiks og ricinusolje.
Det brukes som løsningsmiddel for bestemmelse av krom og brukes som et ekstraksjonsmiddel for jern, kobolt og nikkel. Det brukes også som løsemiddel for oljemaling og gamle lakker. I tillegg brukes den til produksjon av neglelakk.
Denne esteren brukes som fortynningsmiddel i produksjonen av eddiksyre. Petroleum brukes som råmateriale i en oksidasjonsprosess som produserer en vandig løsning av eddiksyre og andre forbindelser, som maursyre og propionsyre..
Som løsningsmiddel og bærer for andre stoffer ble det brukt i de tidlige dagene i luftfartsindustrien for å beskytte stoffene til flyvingene..
Dufter
-Den brukes som luftfrisker for å dekke over dårlig lukt.
-Den brukes som en parfyme i lakken på skoene.
-For å teste effektiviteten til gassmasker, da isoamylacetat har en veldig lav luktterskel og er ikke veldig giftig.
-Den brukes i produksjonen av dufter som Kypros; den myke duftende osmanthusen; hyasinten; og den sterke orientalske smaken, brukt i lave doser, mindre enn 1%.
Andre
Den brukes til produksjon av silke og kunstige perler, fotografiske filmer, vanntette lakker og bronzere. Den brukes også i tekstilindustrien i farging og etterbehandling. Det brukes i renseri av klesartikler og tøymøbler.
I tillegg brukes isoamylacetat i produksjonen av rayon, et syntetisk stoff; i ekstraksjonen av penicillin, og som en standard substans i kromatografi.
Risiko
Isoamylacetat kan irritere huden og øynene ved fysisk kontakt. Innånding kan forårsake irritasjon i nese, hals og lunger. I mellomtiden kan eksponering for høye konsentrasjoner forårsake hodepine, døsighet, svimmelhet, svimmelhet, tretthet og besvimelse..
Langvarig hudkontakt kan føre til at den blir tørr og sprukket..
Referanser
- Bilbrey Jenna. (30. juli 2014). Isoamylacetat. Chemistry World av The Royal Society of Chemistry. Gjenopprettet fra: chemistryworld.com
- Nasjonalt senter for bioteknologisk informasjon. (2019). Isoamylacetat. PubChem-database. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Isoamylacetat. Gjenopprettet fra: en.wikipedia.org
- Royal Society of Chemistry. (2015). Isoamylacetat. Chemspider. Gjenopprettet fra: chemspider.com
- New Jersey Department of Health and Senior Services. (2005). Isoamylacetat. [PDF]. Gjenopprettet fra: nj.gov
- Kjemisk bok. (2017). Isoamylacetat. Gjenopprettet fra: chemicalbook.com


Ingen har kommentert denne artikkelen ennå.