
EMB agarfundament, klargjøring og bruk
De EMB-agar er et selektivt og differensielt fast dyrkningsmedium brukt til isolering av gramnegative basiller, hovedsakelig av Enterobacteriaceae-familien, og andre ikke-kresne gramnegale basiller. Det er også kjent under akronymet EAM, som står for eosin-metylenblått..
Dette mediet ble opprettet av Holt-Harris og Teague i 1916. Det inneholder pepton, laktose, sukrose, dikaliumfosfat, agar, eosin, metylenblått og vann. Det ligner veldig på MacConkey Agar, spesielt når du bruker Levines Modified EMB Agar, som ikke inneholder sukrose..
Faktisk bestemmer hvert laboratorium om de skal jobbe med det ene eller det andre, siden de oppfyller samme funksjon, selv om de er biokjemiske..
Den har til og med den samme ulempen som klassisk MacConkey-agar når det gjelder svermeproduksjon av slekten Proteus. Derfor, for å unngå dette fenomenet, kan agarkonsentrasjonen økes med opptil 5%..
Artikkelindeks
- 1 Begrunnelse
- 1.1 Selektiv
- 1.2 Differensial
- 2 Klargjøring
- 3 bruksområder
- 4 Kvalitetskontroll
- 5 Avsluttende hensyn
- 6 Referanser
Basis
Selektiv
EMB-agar er subtilt selektiv fordi den inneholder anilinfargestoffene (eosin og metylenblått), som fungerer som hemmere, og forhindrer veksten av de fleste Gram-positive bakteriene og noen kresne Gram-negative stenger..
Denne agaren har imidlertid den ulempen at noen Gram-positive bakterier kan motstå tilstedeværelsen av hemmende stoffer og vokse som små fargeløse kolonier, som f.eks. Enterococcus faecalis og noe Staphylococcus.
Visse gjær kan også vokse, for eksempel Candida albicans-kompleks, som vil gi veldig små rosa kolonier. Chlamydospores kan til og med utvikle seg fra denne gjæren hvis prøven er dypfrøet..
Differensial
På den annen side er EMB-agar også et differensialmedium, siden disse fargestoffene sammen (eosin og metylenblått) har egenskapen til å danne et bunnfall ved sur pH, derfor tjener de som indikatorer for produksjonen..
Dermed produserer svakt laktose- eller sukrose-gjærende bakterier lilla kolonier innen 24 til 48 timer. For eksempel slektene Klebsiella, Enterobacter og Serratia.
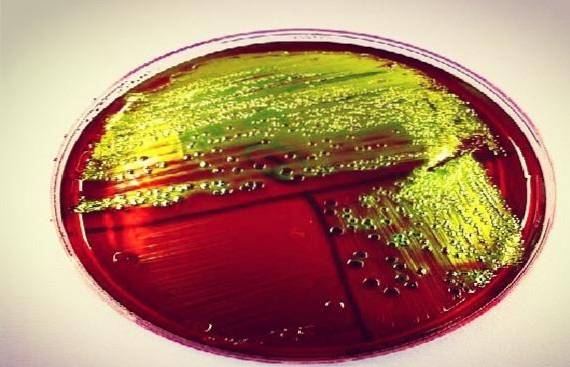
De bakteriene som gjærer laktose sterkt, for eksempel Escherichia coli, eller sukrose, som Yersinia enterocolitica eller Proteus penneri, danner et grønn-svart bunnfall, noe som gir et karakteristisk metallisk glansutseende hos disse artene.
Det bør bemerkes at hvis EMB-levinemedium (uten sukrose) brukes, Yersinia enterocolitica Y Proteus penneri vil gi klare kolonier.
Bakterier som ikke gjærer laktose eller sukrose næres av tilstedeværelsen av peptoner, som gir aminosyrene og nitrogenet som er nødvendig for bakterievekst, og produserer klare kolonier. For eksempel blant annet slektene Salmonella og Shigella.
På samme måte er det viktig å merke seg at Acinetobacter-slekten kan presentere lavendelblå kolonier, selv om det ikke er en laktosefermenter eller sukrose, men har egenskapen til å feste metylenblått på celleveggen. Dette kan også skje med andre oksidative bakterier.
Forberedelse
Det opprinnelige dehydratiserte mediet har lys beige farge.
For å fremstille dette kulturmediet må 36 gram av det dehydratiserte mediet veies og suspenderes i en kolbe som inneholder en liter destillert vann..
Etter at blandingen har hvilt i 5 minutter, ta kolben til en varmekilde, bland kraftig og kontinuerlig til den koker og oppløses helt..
Deretter må det allerede oppløste dyrkningsmediet steriliseres ved hjelp av autoklaven ved 121 ° C i 15 minutter..
På slutten av tiden fjernes den fra autoklaven og får hvile kort. Så, fortsatt varm (45-50 ° C), serveres 15-20 ml agar i hver steril petriskål. Mediet skal være lakmusblått.
Etter servering blir platene litt avdekket til agaren avkjøles litt. De dekkes så og får størkne helt. Deretter bestilles de i omvendte tallerkenholdere og oppbevares i kjøleskap (8 ° C) til bruk..
Denne prosedyren utføres fortrinnsvis i en laminær hette eller foran Bunsen-brenneren for å unngå forurensning.
Det er viktig å huske på at hvert kommersielle hus vil indikere mengden som skal veies for å forberede kulturmediet..
Den endelige pH-verdien til mediet må være 7,2 ± 0,2
applikasjoner
Dette mediet brukes til å så urin og avføring eller en hvilken som helst type klinisk prøve, spesielt hvis det er mistanke om tilstedeværelsen av ikke-kresne gramnegative basiller, for eksempel basillene som tilhører Enterobacteriaceae-familien, som vokser veldig bra på dette mediet..
Enteropatogene bakterier av slektene Shigella og Salmonella preges av sine fargeløse eller litt gule kolonier.
Andre ikke-laktose-gjærende basiller vokser også som Aeromonas, Pseudomonas, Acinetobacter, blant andre..
Likeledes er dette mediet veldig nyttig i mikrobiologisk analyse av mat og vann, da det er ideelt for den komplette bekreftelsesfasen for bestemmelse av koliforme, det vil si å bekrefte tilstedeværelsen av E coli fra uklare EC-buljonger, fra den mest sannsynlige tallteknikken (MPN).
QA
For å verifisere at det nylagde kulturmediet fungerer bra, kan kontrollstammer plantes for å observere egenskapene til koloniene og verifisere at de gir som forventet..
For dette, ATCC stammer eller godt identifiserte stammer av E coli, Enterobacter aerogenes, Klebsiella sp, Salmonella typhimurium, Shigella flexneri, Pseudomonas aeruginosa og noen Gram-positive bakterier, for eksempel S. aureus.
Det forventes at E coli Generer godt utviklede blåsvarte kolonier med grønn metallisk glans. Samtidig som, Enterobacter aerogenes Y Klebsiella sp de skal gi velutviklede blå-sorte slimete kolonier.
For sin del, Salmonella typhimurium Y Shigella flexneri, skal utvikle store, fargeløse eller litt gule kolonier.
Endelig sjangeren Pseudomonas aeruginosa vokser som fargeløse kolonier av uregelmessig størrelse, mens grampositive bakterier bør være fullstendig hemmet eller vokse tynt med veldig små kolonier.
Siste tanker
Noen ganger fører sterilisering til at metylenblått reduseres, og viser en middels oransje farge. For at metylenblått skal oksidere og gjenopprette den lilla fargen, må den blandes forsiktig til fargen er gjenvunnet..
Også etter sterilisering kan fargestoffet utfelles, så det må blandes godt før du serverer petriskålene..
Referanser
- Camacho A, Giles M, Ortegón A, Palao M, Serrano B og Velázquez O. 2009. Teknikker for mikrobiologisk analyse av matvarer. 2. utg. Fakultet for kjemi, UNAM. Mexico.
- Carranza C, León R, Falcón N, Neumann A, Kromm C. Karakterisering og distribusjon av stammer av Escherichia coli Potensielt patogen isolert fra slaktekyllinger fra fjørfebedrifter i Peru. Pastor investiga. veterinær. Peru 2012 23 (2): 209-219. Tilgjengelig på: scielo.org.
- Laboratorios Conda S.A. Eosin og metylenblå agar. 2010. Tilgjengelig på: condalab.com
- Britannia Laboratories. Levine E.M.B (With Eosin and Methylene Blue) 2011.Tilgjengelig på: britanialab.com
- BD Laboratories. BD EMB Agar (Eosin Methylene Blue Agar), modifisert. 2013. Tilgjengelig på: bd.com
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. (5. utg.). Argentina, redaksjonelt Panamericana S.A.
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scott mikrobiologisk diagnose. 12. utg. Argentina. Redaksjonell Panamericana S.A



Ingen har kommentert denne artikkelen ennå.