
Primær alkoholstruktur, egenskaper, nomenklatur, eksempler
EN primær alkohol er en hvor hydroksylgruppen er bundet til et primært karbon; det vil si et karbon bundet kovalent til et annet karbon og hydrogener. Den generelle formelen er ROH, spesielt RCHtoOH, siden det bare er en alkylgruppe R.
R-gruppen med formelen RCHtoOH kan være hvilken som helst: en kjede, en ring eller heteroatomer. Når det gjelder en kjede, kort eller lang, har vi å gjøre med de mest representative primære alkoholene; blant dem er metanol og etanol, to av de mest syntetiserte på industrielt nivå.

Fysisk er de som andre alkoholer, og kokepunktene eller smeltepunktene avhenger av graden av forgrening; men kjemisk er de mest reaktive. I tillegg er surheten høyere enn den for sekundære og tertiære alkoholer.
Primære alkoholer gjennomgår oksidasjonsreaksjoner og blir et stort antall organiske forbindelser: estere og etere, aldehyder og karboksylsyrer. På samme måte kan de gjennomgå dehydrasjonsreaksjoner og transformere til alkener eller olefiner.
Artikkelindeks
- 1 Strukturen til en primær alkohol
- 2 eiendommer
- 2.1 Surhet
- 2.2 Kjemiske reaksjoner
- 3 Nomenklatur
- 4 Eksempler
- 5 Referanser
Strukturen til en primær alkohol
De primære alkoholene avledet fra lineære alkaner er de mest representative. Imidlertid kan enhver struktur, uansett om den er lineær eller forgrenet, klassifiseres i denne typen alkoholer så lenge OH-gruppen er knyttet til en CHto.
Så strukturelt har de alle felles tilstedeværelsen av gruppen -CHtoOH, kalt metylol. En karakteristikk og konsekvens av dette faktum er at OH-gruppen er mindre hindret; det vil si at den kan samhandle med miljøet uten romlig forstyrrelse fra andre atomer.
På samme måte betyr en mindre hindret OH at karbonatomet som bærer det, det til CHto, kan gjennomgå substitusjonsreaksjoner gjennom en SN-mekanismeto (bimolekylær, uten dannelse av karboklassering).
På den annen side blir en OH med større frihet til å samhandle med mediet oversatt som sterkere intermolekylære interaksjoner (ved hydrogenbindinger), som igjen øker smelte- eller kokepunktene..
Det samme skjer med dets løselighet i polare løsningsmidler, så lenge R-gruppen ikke er veldig hydrofob..
Eiendommer
Surhet
Primæralkoholene er av de mest sure. For at en alkohol skal oppføre seg som en Bronsted-syre, må du donere en H-ion+ til mediet, for å si vann, for å bli et alkoksidanion:
ROH + HtoELLER <=> RO- + H3ELLER+
Den negative ladningen av RO-, spesielt fra RCHtoELLER-, blir mindre frastøtt av elektronene i de to CH-bindingene enn av elektronene i CR-bindingen.
Alkylgruppen utøver så den største frastøtingen, destabiliserende RCHtoELLER-; men ikke så mye sammenlignet med at hvis det var to eller tre R-grupper, som skjer med henholdsvis sekundære og tertiære alkoholer.
En annen måte å forklare den høyere surheten til en primær alkohol på, er gjennom elektronegativitetsforskjellen, og skaper dipolmomentet: HtoCδ+-ELLERδ-H. Oksygen tiltrekker elektrondensitet fra begge CHto som fra H; den positive delladningen av karbon frastøter litt den for hydrogen.
R-gruppen overfører noe av sin elektrontetthet til CHto, som hjelper til med å redusere den positive delladningen og med den frastøtingen for hydrogenladningen. Jo flere R-grupper det er, jo lavere frastøting, og derfor er tendensen til H å frigjøres som H+.
pKa
Primære alkoholer betraktes som svakere syrer enn vann, med unntak av metylalkohol, som er litt sterkere. PKa av metylalkohol er 15,2; og pKa av etylalkohol er 16,0. I mellomtiden er pKa med vann 15,7.
Imidlertid kan vann, som regnes som en svak syre, som alkoholer, binde seg til H+ å transformere seg til hydroniumionen, H3ELLER+; det vil si at den oppfører seg som en base.
På samme måte kan primære alkoholer ta opp hydrogen; spesielt i noen av sine egne reaksjoner, for eksempel i transformasjonen til alkener eller olefiner.
Kjemiske reaksjoner
Dannelse av alkylhalogenider
Alkoholer reagerer med hydrogenhalogenider for å produsere alkylhalogenider. Reaktiviteten til alkoholer mot hydrogenhalogenider avtar i følgende rekkefølge:
Tertiær alkohol> sekundær alkohol> primær alkohol
ROH + HX => RX + HtoELLER
RX er et primært alkylhalogenid (CH3Cl, CH3CHtoBr, etc.).
En annen måte å fremstille alkylhalogenider er ved å omsette tionylklorid, et syntetisk reagens, med en primær alkohol som omdannes til et alkylklorid. Tionylklorid (SOClto) krever tilstedeværelse av pyridin for å reagere.
CH3(CHto)3CHtoOH + SOClto => CH3(CHto)3CHtoCl + SOto + HCl
Denne reaksjonen tilsvarer halogeneringen av 1-pentanol for å bli 1-klorpentan i nærvær av pyridin.
Oksidasjon av primære alkoholer
Alkoholer kan oksideres til aldehyder og karboksylsyrer, avhengig av reagenset. Pyridiniumklorokromat (PCC) oksyderer primæralkohol til aldehyd ved bruk av diklormetan (CHtoClto):
CH3(CHto)5CHtoOH => CH3(CHto)5COH
Dette er oksidasjonen av 1-heptanol til 1-heptanal.
I mellomtiden kaliumpermanganat (KMnO4) oksyderer først alkoholen til aldehyd, og oksyderer deretter aldehydet til karboksylsyre. Når kaliumpermanganat brukes til å oksidere alkoholer, må brytningen av bindingen mellom karbon 3 og 4 unngås..
CH3(CHto)4CHtoOH => CH3(CHto)4COOH
Dette er oksidasjon av 1-heksanol til heksansyre.
Ved denne metoden er det vanskelig å oppnå et aldehyd, siden det lett oksyderes til en karboksylsyre. En lignende situasjon observeres når kromsyre brukes til å oksidere alkoholer.
Dannelse av etere
Primære alkoholer kan omdannes til etere ved oppvarming i nærvær av en katalysator, vanligvis svovelsyre:
2 RCHtoOH => RCHtoOCHtoR + HtoELLER
Dannelse av organiske estere
Kondensasjonen av en alkohol og en karboksylsyre, Fishers forestring, katalysert av en syre, gir en ester og vann:
R'OH + RCOOH <=> RCOOR '+ HtoELLER
En velkjent reaksjon er den av etanol med eddiksyre for å gi etylacetat:
CH3CHtoOH + CH3COOH <=> CH3COOHCHtoCH3 + HtoELLER
Primæralkohol er den mest utsatt for Fischer-forestringsreaksjoner.
Dehydrering
Ved høye temperaturer og i et surt medium, vanligvis svovelsyre, dehydrerer alkoholer for å danne alkener med tap av et vannmolekyl..
CH3CHtoOH => HtoC = CHto + HtoELLER
Dette er dehydratiseringsreaksjonen av etanol til etylen. En mer passende generell formel for denne typen reaksjoner, spesielt for en primær alkohol, vil være:
RCHtoOH => R = CHto (som også er lik RC = CHto)
Nomenklatur
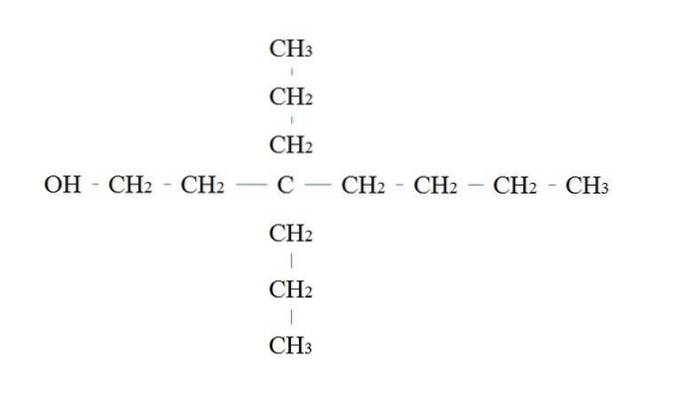
Reglene for å navngi en primæralkohol er de samme som for de andre alkoholene; med unntak av at det noen ganger ikke er nødvendig å liste opp det OH-bærende karbonet.
I det øvre bildet er det en syv-karbon hovedkjede. Karbonet bundet til OH tildeles tallet 1, og deretter begynner det å telles fra venstre til høyre. IUPAC-navnet er derfor: 3,3-dietylheptanol.
Merk at dette er et eksempel på en meget forgrenet primæralkohol.
Eksempler
Til slutt nevnes noen primære alkoholer basert på deres tradisjonelle og systematiske nomenklatur:
-Metyl, CH3Åh
-Etyl, CH3CHtoÅh
-n-propyl, CH3CHtoCHtoÅh
-n-heksyl, CH3CHtoCHtoCHtoCHtoCHtoÅh
Dette er derivater av lineære alkaner. Andre eksempler er:
-2-fenyletanol, C6H5CHtoCHtoOH (C6H5 = benzenring)
-2-propen-1-ol (allylalkohol), CHto= CHCHtoÅh
-1,2-etandiol, CHtoOHCHtoÅh
-2-kloretanol (etylenklorhydrin), ClCHtoCHtoÅh
-2-buten-1-ol (crotylalkohol), CH3CH = CHCHtoÅh
Referanser
- Morrison, R.T. og Boyd, R. N. (1987). Organisk kjemi. (5ta Utgave). Addison-Wesley Iberoamericana
- Carey, F. A. (2008). Organisk kjemi. (6ta Utgave). McGraw-Hill, Interamerica, Editores S.A.
- Mel Science. (2019). Hvordan oksidasjonen av primære alkoholer foregår. Gjenopprettet fra: melscience.com
- Royal Society of Chemistry. (2019). Definisjon: primære alkoholer. Gjenopprettet fra: rsc.org
- Chriss E. McDonald. (2000). Oksidasjonen av primære alkoholer til estere: Tre relaterte etterforskningseksperimenter. J. Chem. Utdanning., 2000, 77 (6), s 750. DOI: 10.1021 / ed077p750


Ingen har kommentert denne artikkelen ennå.