
Sekundær alkoholstruktur, egenskaper, nomenklatur, bruksområder
EN sekundær alkohol Den har bærer karbon i hydroksylgruppen (OH), festet til to karbonatomer. Mens i primæralkohol er karbonet som bærer hydroksylgruppen bundet til ett karbonatom, og i tertiær alkohol er det festet til tre karbonatomer..
Alkoholer er litt svakere syrer enn vann, med følgende pKa: vann (15,7); metyl (15,2), etyl (16), isopropyl (sekundær alkohol, 17) og tert-butyl (18) alkoholer. Som det fremgår er isopropylalkohol mindre sur enn metyl- og etylalkoholer..
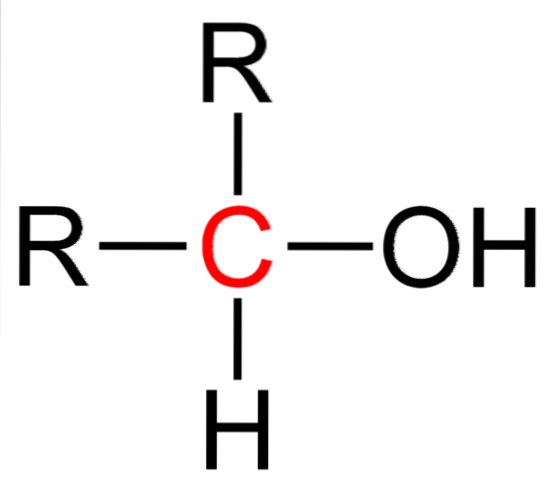
Det øvre bildet viser strukturformelen for en sekundær alkohol. Kullet i rødt er bæreren av OH, og er koblet til to alkyl (eller aryl) grupper R og et enkelt hydrogenatom.
Alle alkoholer har den generiske formelen ROH; men hvis bærerkarbonet blir observert i detalj, så er de primære alkoholene (RCHtoOH), sekundær (RtoCHOH, her oppvokst) og tertiær (R3COH). Dette faktum gjør en forskjell i dets fysiske egenskaper og reaktivitet..
Artikkelindeks
- 1 Strukturen til en sekundær alkohol
- 2 eiendommer
- 2.1 Kokepunkter
- 2.2 Surhet
- 2.3 Reaksjoner
- 3 Nomenklatur
- 4 bruksområder
- 5 eksempler
- 5.1 2-oktanol
- 5.2 Østradiol eller 17β-østradiol
- 5.3 20-hydroksy-leukotrien
- 5.4 2-Heptanol
- 6 Referanser
Strukturen til en sekundær alkohol
Strukturen til alkoholene avhenger av naturen til R-gruppene, men for sekundære alkoholer kan det gjøres noen eksempler, med tanke på at det bare kan være lineære strukturer med eller uten grener eller sykliske strukturer. For eksempel har du følgende bilde:
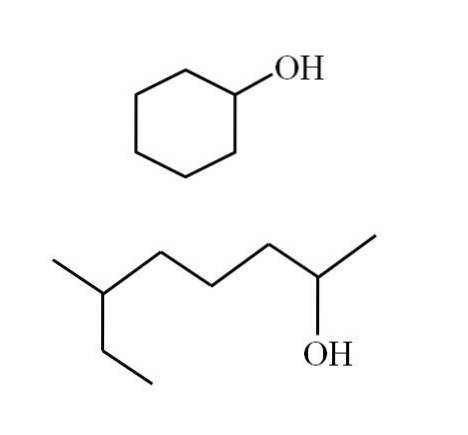
Merk at for begge strukturer er det noe til felles: OH er knyttet til en "V". Hver ende av V representerer en lik R-gruppe (øvre del av bildet, syklisk struktur) eller forskjellig (nedre del, forgrenet kjede).
På denne måten identifiseres enhver sekundær alkohol veldig enkelt, selv om nomenklaturen i det hele tatt ikke er kjent..
Eiendommer
Kokepunkter
Egenskapene til sekundære alkoholer skiller seg fysisk ikke for mye fra andre alkoholer. De er vanligvis gjennomsiktige væsker, og for å være et fast stoff ved romtemperatur må det danne flere hydrogenbindinger og ha høy molekylvekt.
Imidlertid har den samme strukturformelen RtoCHOH antyder visse egenskaper som er unike for disse alkoholene generelt. For eksempel er OH-gruppen mindre eksponert og tilgjengelig for hydrogenbindingsinteraksjoner, RtoCH-OH-OHCHRto.
Dette er fordi R-gruppene, ved siden av det OH-bærende karbonet, kan komme i veien og hindre dannelsen av hydrogenbindinger. Som et resultat har sekundære alkoholer lavere kokepunkter enn primære alkoholer (RCHtoÅH).
Surhet
I følge Brönsted-Lowry-definisjonen er en syre en som donerer protoner eller hydrogenioner, H+. Når dette skjer med sekundær alkohol, har du:
RtoCHOH + B- => RtoCHO- + HB
Den konjugerte basen RtoCHO-, alkoksidanion, må stabilisere den negative ladningen. For sekundæralkoholen er stabiliseringen lavere siden de to R-gruppene har elektronisk tetthet, som til en viss grad avviser den negative ladningen på oksygenatomet..
I mellomtiden, for alkoksidanionen til en primær alkohol, RCHtoELLER-, det er mindre elektronisk frastøt da det bare er en R-gruppe og ikke to. I tillegg utøver ikke hydrogenatomene noen signifikant frastøting, og tvert imot, bidrar til å stabilisere den negative ladningen..
Derfor er sekundære alkoholer mindre sure enn primære alkoholer. Hvis dette er slik, er de mer grunnleggende, og av nøyaktig samme grunner:
RtoCHOH + HtoB+ => RtoCHOHto+ + HB
Nå stabiliserer R-gruppene den positive ladningen på oksygen ved å gi opp en del av elektrontettheten..
Reaksjoner
Hydrogenhalogenid og fosfortrihalogenid
En sekundær alkohol kan reagere med et hydrogenhalogenid. Den kjemiske ligningen av reaksjonen mellom isopropylalkohol og hydrobromsyre, i et svovelsyremedium, og produserende isopropylbromid er vist:
CH3CHOHCH3 + HBr => CH3CHBrCH3 + HtoELLER
Og det kan også reagere med et fosfor trihalogen, PX3 (X = Br, I):
CH3-CHOH-CHto-CHto-CH3 + PBr3 => CH3-CHBr-CHto-CHto-CH3 + H3PO3
Ovennevnte kjemiske ligning tilsvarer reaksjonen mellom Sec-pentanol og fosfortribromid, med opprinnelse fra sec-pentylbromid.
Merk at i begge reaksjoner et sekundært alkylhalogenid (RtoCHX).
Dehydrering
I denne reaksjonen går en H og en OH fra nærliggende karbon tapt, og danner en dobbeltbinding mellom disse to karbonatomer. Derfor er det dannelsen av et alken. Reaksjonen krever en syrekatalysator og tilførsel av varme.
Alkohol => Alkene + HtoELLER
For eksempel har vi følgende reaksjon:
Sykloheksanol => Sykloheksen + HtoELLER
Reaksjon med aktive metaller
Sekundære alkoholer kan reagere med metaller:
CH3-CHOH-CH3 + K => CH3CHO-K+CH3 + ½ H+
Her reagerer isopropylalkohol med kalium for å danne isoproksidsaltet av kalium og hydrogenioner..
Forestring
Den sekundære alkoholen reagerer med en karboksylsyre og danner en ester. For eksempel er den kjemiske ligningen for reaksjonen av sek-butylalkohol med eddiksyre for å produsere sek-butylacetat vist:
CH3CHOHCHtoCH3 + CH3COOH <=> CH3COOCHCH3CHtoCH3
Oksidasjon
Primære alkoholer oksyderes til aldehyder, og disse blir oksidert til karboksylsyrer. Men sekundæralkoholene oksyderes til aceton. Reaksjonene katalyseres vanligvis av kaliumdikromat (KtoCrO7) og kromsyre (HtoCrO4).
Den generelle reaksjonen er:
RtoCHOH => RtoC = O
Nomenklatur
Sekundære alkoholer er navngitt som indikerer posisjonen til OH-gruppen i hovedkjeden (lengste). Dette tallet går foran navnet, eller det kan komme etter navnet på den respektive alkanen for kjeden.
For eksempel CH3CHtoCHtoCHtoCHOHCH3, er 2-heksanol eller heksan-2-ol.
Hvis strukturen er syklisk, er det ikke nødvendig å plassere en teller; med mindre det er andre substituenter. Dette er grunnen til at den sykliske alkoholen i det andre bildet kalles cykloheksanol (ringen er sekskantet).
Og for den andre alkoholen med samme bilde (den forgrenede), heter den: 6-etyl-heptan-2-ol.
applikasjoner
-Sec-butanol brukes som løsemiddel og kjemisk mellomprodukt. Den er tilstede i hydrauliske væsker for bremser, industrielle rengjøringsmidler, polering, malingstrippere, mineralflytemidler og fruktessenser og parfymer..
-Isopropanolalkohol brukes som et industrielt løsningsmiddel og som et antikoagulasjonsmiddel. Den brukes i oljer og hurtigtørkende blekk, som et antiseptisk middel og erstatning for etanol i kosmetikk (for eksempel: hudkremer, hårfarger og spritalkohol).
-Isopropanol er en ingrediens i flytende såper, glassrengjøringsmidler, syntetiske smaker i alkoholfrie drikkevarer og matvarer. I tillegg er det et mellomkjemikalie.
-Sykloheksanol brukes som løsningsmiddel, i tekstilbehandling, i lærbehandling og som emulgator i såper og syntetiske vaskemidler..
-Metylcykloheksanol er en ingrediens i såpebaserte flekkfjernere og spesialvaskemidler.
Eksempler
2-oktanol

Det er en fettalkohol. Det er en fargeløs væske, litt løselig i vann, men løselig i de fleste ikke-polære løsemidler. Det brukes blant annet til produksjon av smaker og dufter, maling og belegg, blekk, lim, hjemmepleie og smøremidler.
Østradiol eller 17β-østradiol

Det er et steroid kjønnshormon. Den har to hydroksylgrupper i strukturen. Det er det dominerende østrogen i reproduksjonsårene.
20-hydroksy-leukotrien
Det er en metabolitt som sannsynligvis stammer fra oksidasjon av leukotrienlipid. Det er klassifisert som et cystinylleukotrien. Disse forbindelsene er formidlere av den inflammatoriske prosessen som bidrar til de patofysiologiske egenskapene til allergisk rhinitt..
2-Heptanol
Det er en alkohol som finnes i frukt. Det finnes også i ingefærolje og jordbær. Den er gjennomsiktig, fargeløs og uoppløselig i vann. Det brukes som løsningsmiddel for forskjellige harpikser og griper inn i flotasjonsfasen i mineralforedling.
Referanser
- James. (17. september 2014). Alkoholer (1) - Nomenklatur og egenskaper. Gjenopprettet fra: masterorganicchemistry.com
- Encyclopedia of Health and Safety at Work. (s.f.). Alkoholer. [PDF]. Gjenopprettet fra: insht.es
- Clark J. (16. juli 2015). Struktur og klassifisering av alkoholer. Kjemi Libretexts. Gjenopprettet fra: chem.libretexts.org
- PubChem. (2019). 20-hydroksy-leukotrien E4. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kjemi. 5ta Utgave. Redaksjonell Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10th utgave.). Wiley pluss.
- Wikipedia. (2018). 2-oktanol. Gjenopprettet fra: en.wikipedia.org



Ingen har kommentert denne artikkelen ennå.