
Allotropi Allotropisk transformasjon og hovedelementer

De allotropi i kjemi er det kjennetegnet visse kjemiske elementer har for å presentere seg i flere forskjellige former, men i samme tilstand av aggregering av materie. Elementenes struktur kan variere avhengig av deres molekylære arrangement og forholdene de dannes i, for eksempel trykk og temperatur..
Bare når det gjelder kjemiske elementer, brukes ordet allotropi, som betegner hver av måtene et element kan bli funnet i samme fase som en allotrop; mens forbindelser som har forskjellige krystallinske strukturer ikke gjelder; i dette tilfellet kalles det polymorfisme.
Andre tilfeller er kjent, slik som oksygen, der allotropi kan oppstå som en endring i antall atomer i stoffet. I denne forstand er det en forestilling om to allotroper av dette elementet, som er bedre kjent som oksygen (Oto) og ozon (O3).
Artikkelindeks
- 1 Allotropisk transformasjon
- 2 Hovedallotropiske elementer
- 2.1 Karbon
- 2.2 Svovel
- 2.3 Fosfor
- 2.4 Oksygen
- 3 Referanser
Allotropisk transformasjon
Som tidligere nevnt er allotroper de forskjellige måtene det samme elementet kan bli funnet på, så denne variasjonen i strukturen får disse artene til å vises med forskjellige fysiske og kjemiske egenskaper..
Likeledes skjer den allotropiske transformasjonen mellom ett element og et annet ved måten atomer er ordnet i molekylene; det vil si måten linken har sin opprinnelse på.
Denne endringen mellom en allotrop og en annen kan forekomme av forskjellige årsaker, for eksempel endringer i forholdene til trykk, temperatur og til og med forekomsten av elektromagnetisk stråling som lys..
Når strukturen til en kjemisk art endres, kan den også endre oppførselen, endre egenskaper som elektrisk ledningsevne, hardhet (i tilfelle faste stoffer), smelte- eller kokepunkt og til og med fysiske egenskaper som fargen..
I tillegg kan allotropi være av to typer:
- Monotropisk, når en av elementstrukturene har større stabilitet enn de andre under alle forhold.
- Enanthropic, når de forskjellige strukturene er stabile under forskjellige forhold, men kan forvandle seg til hverandre på en reversibel måte ved visse trykk og temperaturer.
Hovedallotropiske elementer
Selv om det er mer enn hundre kjente elementer i det periodiske systemet, har ikke alle allotropiske former. De mest kjente allotropene er presentert nedenfor.
Karbon
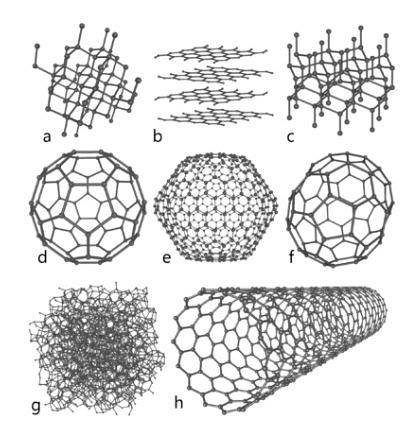
Dette elementet med stor overflod i naturen representerer det grunnleggende grunnlaget for organisk kjemi. Flere allotropiske arter av dette er kjent, blant hvilke diamanter, grafitt og andre som vil bli utsatt nedenfor skiller seg ut..
Diamant
Diamanten viser et molekylært arrangement i form av tetraedriske krystaller hvis atomer er bundet av enkeltbindinger; dette betyr at de er ordnet med hybridisering sp3.
Grafitt
Grafitt består av påfølgende karbonark, der atomene er bundet i sekskantede strukturer med dobbeltbindinger; altså med hybridisering spto.
Carbino
I tillegg til de to viktige allotropene nevnt ovenfor, som er mest kjent for karbon, er det andre som karbyne (som lineært acetylenkarbon, LAC, er også kjent), der dets atomer er ordnet på en lineær måte gjennom trippelbindinger; altså med hybridisering sp.
Andre
- Grafen, hvis struktur er veldig lik grafitt).
- Fullerene eller buckminsterfullerene, også kjent som buckyball, hvis struktur er sekskantet men atomene er ordnet i form av en ring.
- Nanorør av karbon, sylindrisk i form.
- Amorf karbon, uten krystallinsk struktur.
Svovel
Svovel har også flere allotroper som er vanlige, for eksempel følgende (det skal bemerkes at alle disse er i fast tilstand):
Rhombisk svovel
Som navnet antyder, består den krystallinske strukturen av åttekantede romber og er også kjent som α svovel..
Monoklinisk svovel
Kjent som β-svovel, den har form av et prisme som består av åtte svovelatomer.
Smeltet svovel
Den produserer prismatiske krystaller som er stabile ved visse temperaturer, og danner nåler uten farge..
Plast svovel
Også kalt svovel, den har en amorf struktur.
Flytende svovel
Den har viskositetsegenskaper i motsetning til de fleste elementene, siden den i denne allotropen vokser med økende temperatur.
Kamp
Dette ikke-metalliske elementet finnes ofte i naturen i kombinasjon med andre elementer og har flere tilknyttede allotrope stoffer:
Hvit fosfor
Det er et fast stoff med en tetrahedral krystallstruktur og har anvendelser på militærområdet, til og med brukt som et kjemisk våpen..
Svart fosfor
Den har den høyeste stabiliteten blant allotropene til dette elementet og ligner veldig på grafen.
Rød fosfor
Danner et amorft fast stoff med reduserende egenskaper, men er uten giftighet.
Difosfor
Som navnet antyder, består den av to fosforatomer og er en gassform av dette elementet.
Fiolett fosfor
Det er et fast stoff med en krystallinsk struktur med et monoklinisk molekylært arrangement..
Skarlagensfosfor
Også solid amorf struktur.
Oksygen
Til tross for at det er et av de vanligste elementene i jordens atmosfære og et av de mest utbredte elementene i universet, har det få kjente allotroper, blant hvilke dioksygen og trioksygen skiller seg ut..
Dioksygen
Dioksygen er bedre kjent med det enkle navnet oksygen, et gassformig stoff som er viktig for de biologiske prosessene på denne planeten..
Trioxygen
Trioxygen er bedre kjent ganske enkelt som ozon, en svært reaktiv allotrop der den mest kjente funksjonen er å beskytte jordens atmosfære mot eksterne strålingskilder..
Tetraoksygen
Danner en solid fase av trigonal struktur med egenskaper for metastabilitet.
Andre
Det er også seks andre faste arter som oksygen danner, med forskjellige krystallinske strukturer..
På samme måte er det elementer som selen, bor, silisium, blant andre, som presenterer forskjellige allotroper og som har blitt studert med en mindre eller større grad av dybde..
Referanser
- Wikipedia. (s.f.). Allotropi. Gjenopprettet fra en.wikipedia.org
- Chang, R. (2007). Kjemi, niende utgave. Mexico: McGraw-Hill.
- Britannica, E. (s.f.). Allotropi. Hentet fra britannica.com
- ThoughtCo. (s.f.). Allotrop Definisjon og eksempler. Gjenopprettet fra thoughtco.com
- Ciach, R. (1998). Avanserte lyslegeringer og kompositter. Hentet fra books.google.co.ve




Ingen har kommentert denne artikkelen ennå.