
Alkynes egenskaper, struktur, bruksområder og eksempler
De alkyner De er hydrokarboner eller organiske forbindelser som har en trippelbinding mellom to karboner i strukturen. Denne trippelbindingen (≡) betraktes som en funksjonell gruppe da den representerer et aktivt sted i molekylet, og derfor er ansvarlig for deres reaktivitet..
Selv om alkyner ikke er veldig forskjellige fra alkaner eller alkener, viser de større surhet og polaritet på grunn av arten av deres bindinger. Det presise begrepet for å beskrive denne lille forskjellen er det som kalles umettet.

Alkaner er mettede hydrokarboner, mens alkyner er de mest umettede i forhold til den opprinnelige strukturen. Hva betyr dette? At et alkan H3C-CH3 (etan) kan dehydrogeneres til HtoC = CHto (eten) og senere til HC≡CH (etyn, eller bedre kjent som acetylen).
Legg merke til hvordan antallet ekstra hydrogener som er bundet til dem, reduseres når flere bindinger dannes mellom karbonene. Karbon, på grunn av sine elektroniske egenskaper, søker å danne fire enkle bindinger, så jo høyere umettetheten er, desto større er tendensen til å reagere (med unntak av aromatiske forbindelser).
På den annen side er trippelbindingen mye sterkere enn dobbeltbindingen (=) eller enkeltbindingen (-), men til en høy energikostnad. Derfor kan de fleste hydrokarboner (alkaner og alkener) danne trippelbindinger ved forhøyede temperaturer..
Som en konsekvens av de høye energiene til disse, og når de bryter, frigjør de mye varme. Et eksempel på dette fenomenet ses når acetylen brennes med oksygen og den intense varmen fra flammen brukes til å sveise eller smelte metaller (toppbilde).
Acetylen er den enkleste og minste alkynen av alle. Andre hydrokarboner kan uttrykkes fra den kjemiske formelen ved å erstatte H med alkylgrupper (RC≡CR '). Det samme skjer i en verden av organisk syntese gjennom et stort antall reaksjoner.
Denne alkynen er produsert fra reaksjonen av kalsiumoksyd fra kalkstein og koks, et råmateriale som gir de nødvendige karbonene i en elektrisk ovn:
CaO + 3C => CaCto + CO
CaCto Det er kalsiumkarbid, en uorganisk forbindelse som til slutt reagerer med vann for å danne acetylen:
CaCto + 2HtoO => Ca (OH)to + HC≡CH
Artikkelindeks
- 1 Fysiske og kjemiske egenskaper til alkyner
- 1.1 Polaritet
- 1.2 Surhet
- 2 Reaktivitet
- 2.1 Hydrogenering
- 2.2 Tilsette hydrogenhalogenider
- 2.3 Hydrering
- 2.4 Tilsette halogener
- 2.5 Alkylering av acetylen
- 3 Kjemisk struktur
- 3.1 Avstand mellom koblinger og terminal alkyner
- 4 Nomenklatur
- 5 bruksområder
- 5.1 Acetylen eller etyn
- 5.2 Naturlige alkyner
- 6 Eksempler på alkyner
- 6.1 Taririnsyre
- 6.2 Histrionikotoksin
- 6.3 Cikutoksin
- 6.4 Capillin
- 6.5 Pargyline
- 7 Referanser
Fysiske og kjemiske egenskaper til alkyner
Polaritet
Trippelbindingen skiller alkyner fra alkaner og alkener. De tre typer hydrokarboner er apolare, uoppløselige i vann og veldig svake syrer. Elektronegativiteten til dobbelt- og tredobbeltkarbonene er imidlertid større enn den for enkeltkarbonene..
Følgelig gir karbonene ved siden av trippelbindingen negativ ladningstetthet ved induktiv effekt. Av denne grunn, hvor C≡C- eller C = C-bindingene er, vil det være en høyere elektrontetthet enn i resten av karbonskjelettet. Som en konsekvens er det et lite dipolmoment der molekylene samhandler med dipol-dipolkrefter..
Disse interaksjonene er veldig svake hvis dipolmomentene deres sammenlignes med vannmolekylets eller alkohol. Dette gjenspeiles i deres fysiske egenskaper: alkyner har generelt høyere smelte- og kokepunkter sammenlignet med deres mindre umettede hydrokarboner..
På grunn av deres lave polaritet er de også mindre uoppløselige i vann, men de er løselige i ikke-polære organiske løsningsmidler som benzen..
Surhet
Dessuten forårsaker denne elektronegativiteten hydrogen HC≡CR er surere enn noe som er tilstede i andre hydrokarboner. Derfor er alkyner surere arter enn alkener og mye surere enn alkaner. Imidlertid er surheten fortsatt ubetydelig sammenlignet med karboksylsyrene..
Siden alkyner er veldig svake syrer, reagerer de bare med veldig sterke baser, for eksempel natriumamid:
HC2CR + NaNHto => HC2CNa + NH3
Fra denne reaksjonen oppnås en løsning av natriumacetylid, råmateriale for syntese av andre alkyner..
Reaktivitet
Reaktiviteten til alkyner forklares ved tilsetning av små molekyler til deres trippelbinding, noe som reduserer deres umettethet. Disse kan godt være hydrogenmolekyler, hydrogenhalogenider, vann eller halogener..
Hydrogenering
Det lille molekylet av Hto det er veldig unnvikende og raskt, så for å øke sjansene for at de tilsettes den tredobbelte bindingen av alkyner, må katalysatorer brukes.
Disse er vanligvis metaller (Pd, Pt, Rh eller Ni) finfordelt for å øke overflatearealet; og dermed kontakten mellom hydrogen og alkyn:
RC≡CR '+ 2Hto => RCHtoCHtoR '
Resultatet er at hydrogenet er "forankret" til at karbonene bryter en binding, og så videre til de produserer den tilsvarende alkanen, RCHtoCHtoR '. Dette metter ikke bare det opprinnelige hydrokarbonet, men endrer også dets molekylære struktur..
Tilsetning av hydrogenhalogenider
Her tilsettes det uorganiske molekylet HX, hvor X kan være hvilket som helst av halogenene (F, Cl, Br eller I):
RC≡CR '+ HX => RCH = CXR'
Hydrering
Hydratiseringen av alkyner er når de tilfører et vannmolekyl for å danne et aldehyd eller et keton:
RC≡CR '+ HtoO => RCHtoCOR '
Hvis R 'er et H, er det et aldehyd; hvis det er et alkyl, så er det et keton. I reaksjonen dannes en forbindelse kjent som enol (RCH = C (OH) R ') som et mellomprodukt..
Dette gjennomgår en konvertering fra enolformen (C-OH) til ketonformen (C = O) i en likevekt kalt tautomerisering.
Tilsette halogener
Og med hensyn til tilsetninger, er de diatomiske molekylene til halogenene (Xto= Fto, Clto, Brto jeg hørteto):
RC≡CR '+ 2Xto => RCXto-CXtoR '
Acetylenalkylering
Andre alkyner kan fremstilles fra natriumacetylidløsningen ved å bruke et alkylhalogenid:
HC2CNa + RX => HC2CR + NaX
For eksempel, hvis det var metyljodid, ville den resulterende alkynen være:
HC2CNa + CH3I => HC≡CCH3 + NaX
HC≡CCH3 er tipset, også kjent som metylacetylen.
Kjemisk struktur
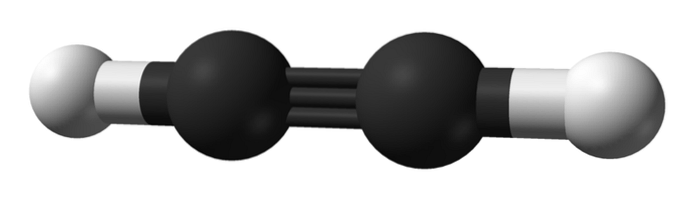
Hva er strukturen til alkyner? Et acetylenmolekyl er vist på det øvre bildet. Fra den kan den lineære geometrien til bindingen C enlaceC tydelig observeres.
Derfor, der det er en trippelbinding, bør strukturen til molekylet være lineær. Dette er en annen av de bemerkelsesverdige forskjellene mellom dem og resten av hydrokarboner.
Alkaner blir vanligvis representert som sikksakk, fordi de har SP-hybridisering3 og linkene deres er 109º fra hverandre. De er faktisk en kjede av kovalent koblet tetraeder. Mens alkenene er flate ved sp-hybridiseringto av karbonene, mer spesifikt danner et trigonalplan med bindinger atskilt med 120º.
I alkyner er orbital hybridisering sp, det vil si at de har 50% s karakter og 50% p karakter. Det er to hybrid sp-orbitaler som binder til H-atomer i acetylen eller til alkylgrupper i alkyner..
Avstanden mellom de to H eller R er 180º, i tillegg til at bare på denne måten kan de rene p-orbitalene til karbonene danne trippelbindingen. Av denne grunn er bindingen -C≡C- lineær. Ser vi på strukturen til ethvert molekyl, skiller -C theC- seg ut i de regionene der skjelettet er veldig lineært.
Avstanden mellom leddene og terminale alkyner
Karbonene i trippelbindingen er nærmere hverandre enn i dobbelt- eller enkeltbindingen. Med andre ord er C2C kortere enn C = C og C-C. Som en konsekvens er bindingen sterkere fordi de to π-bindingene hjelper til med å stabilisere den enkle σ-bindingen..
Hvis trippelbindingen er på slutten av en kjede, er den en terminal alkyn. Derfor må formelen for nevnte forbindelse være HC2CR, hvor H fremhever slutten eller begynnelsen av kjeden.
Hvis det tvert imot er en intern trippelbinding, er formelen RC≡CR ', hvor R og R' er høyre og venstre side av kjeden.
Nomenklatur
Hvordan blir alkyner navngitt i henhold til reglene diktert av IUPAC? På samme måte som alkaner og alkener har blitt kalt. For å gjøre dette endres suffikset -ano eller -eno til suffikset -ino.
For eksempel: HC≡CCH3 den heter propyne, siden den har tre karbonatomer, som propan (CH3CHtoCH3). HC≡CCHtoCH3 er 1-butyne, som er en terminal alkyn. Men i tilfelle CH3C≡CCH3 det er 2-butyne, og i dette er trippelbindingen ikke terminal, men internt.
CH3C≡CCHtoCHto(CH3)to er 5-metyl-2-heksyn. Karbonene telles fra siden nærmest trippelbindingen.
En annen type alkyner er cykloalkiner. For dem er det nok å erstatte suffikset -ano med -ino av den tilsvarende cykloalkanen. Dermed blir cyklopropan som har en trippelbinding kalt cyclopropino (som ikke eksisterer).
Når det er to trippelbindinger, blir prefikset di lagt til navnet. Eksempler er HC2C-C2H, diacetylen eller propadino; og til HC2C-C-C2H, butadiino.
applikasjoner
Acetylen eller etyn
Den minste av alkynene tykner det mulige antall bruksområder for disse hydrokarboner. Fra det, gjennom alkyleringer, kan andre organiske forbindelser syntetiseres. Likeledes gjennomgår det oksidative reaksjoner for å oppnå etanol, eddiksyre, akrylsyre, blant andre..
Andre bruksområder består i å tilveiebringe varmekilden for å begeistre atomene; nærmere bestemt av metallkationer i atomabsorpsjon-utslippsbestemmelser, en mye brukt spektroskopisk teknikk.
Naturlige alkyner
De eneste eksisterende metodene for å fremstille alkyner er ikke bare syntetiske eller med påføring av varme i fravær av oksygen, men også biologiske.
Disse bruker enzymer som kalles acetylenaser, som kan dehydrogenere en dobbeltbinding. Takket være dette oppnås mange naturlige kilder til alkyner.
Som et resultat av dette kan giftstoffer, motgifter, medisiner eller andre forbindelser som gir noen fordeler, ekstraheres fra disse kildene. spesielt når det gjelder helse. Alternativene er mange når du endrer de opprinnelige strukturene og har dem som støtte for nye alkyner..
Eksempler på alkyner
Så langt har mange eksempler på alkyner blitt nevnt. Noen kommer imidlertid fra veldig spesifikke kilder eller har spesielle molekylære strukturer: de er polyacetylener.
Dette betyr at det kan være mer enn en trippelbinding som er en del av en veldig stor struktur, og ikke bare en enkel karbonkjede..
Taririnsyre

Taririnsyre kommer fra en plante som ligger i Guatemala kalt Picramnia tariri. Det er spesielt ekstrahert fra oljen av frøene.
I sin molekylstruktur kan det observeres en enkelt trippelbinding som skiller en apolar hale fra et polært hode; derfor kan det betraktes som et amfipatisk molekyl.
Histrionikotoksin
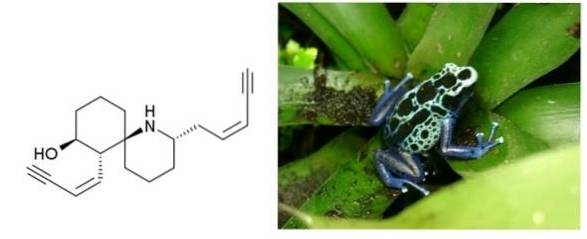
på en.wikipedia [Public domain], fra Wikimedia Commons
Histrionikotoksin er en gift som utskilles av froskene som bor i Colombia, Brasil og andre land i Latin-Amerika. Den har to trippelbindinger konjugert til en dobbeltbinding. Begge er terminale og atskilt med en seks-karbonring og et syklisk amin..
Cicutoxin
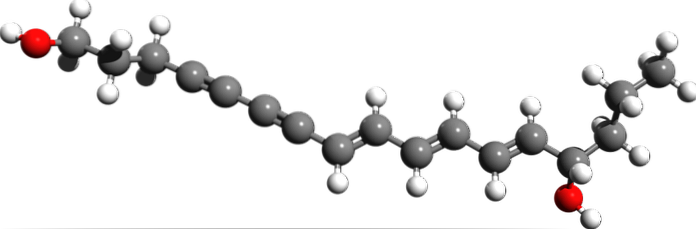
Fra den molekylære strukturen til Cicutoxin, hvor er de tredobbelte bindingene? Hvis dobbeltbindingene er flate, sett til høyre, og enkeltbindingene er tetraeder, som i endene, er tripplene lineære og er i skråningen (\).
Denne forbindelsen består av et nevrotoksin som hovedsakelig finnes i akvatiske hemlockplanter..
Capillina
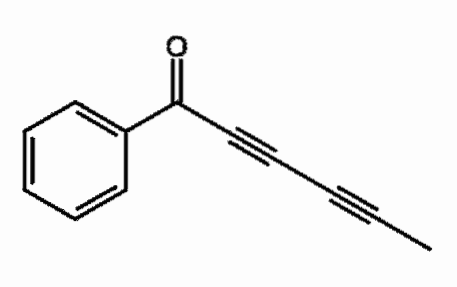
Det er en alkyne som er tilstede i essensiell olje fra krusplanter som brukes som et soppdrepende middel. To påfølgende trippelbindinger kan observeres, mer korrekt konjugert.
Hva betyr det? De tredobbelte bindingene resonerer gjennom hele karbonkjeden og involverer C = O dobbeltbindingsåpning til C-O-.
Pargyline
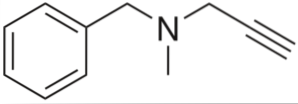
Det er en alkyne med antihypertensiv aktivitet. Når vi analyserer strukturen etter deler, har vi: en benzylgruppe til venstre, en tertiær amin i midten og en propynyl til høyre; det vil si en terminal propygruppe.
Referanser
- Francis A. Carey. Organisk kjemi. Karboksylsyrer. (sjette utg., s. 368-397). Mc Graw Hill.
- Brennan, John. (10. mars 2018). Eksempler på Alkynes. Vitenskapelig. Hentet fra: sciencing.com
- BYJU'S. (2018). Triple Bond i Alkynes. Hentet fra: byjus.com
- Leksikon med eksempler (2017). Alkynes. Gjenopprettet fra: examples.co
- Kevin A. Boudreaux. Alkynes. Hentet fra: angelo.edu
- Robert C. Neuman, Jr. Alkenes og Alkynes. [PDF]. Hentet fra: chem.ucr.edu



Ingen har kommentert denne artikkelen ennå.