
Anhydrider egenskaper, hvordan de dannes og applikasjoner
De anhydrider De er kjemiske forbindelser som stammer fra foreningen av to molekyler gjennom frigjøring av vann. Dermed kunne det sees på som en dehydrering av de opprinnelige stoffene; selv om det ikke er helt sant.
I organisk og uorganisk kjemi nevnes dem, og i begge grener skiller deres forståelse seg i betydelig grad. For eksempel, i uorganisk kjemi betraktes basiske og sure oksyder som henholdsvis anhydrider av deres hydroksider og syrer, siden førstnevnte reagerer med vann og danner sistnevnte..
Her kan det oppstå forvirring mellom begrepene 'vannfri' og 'anhydrid'. Vanligvis refererer vannfri til en forbindelse som den har blitt dehydrert til uten endringer i kjemisk natur (det er ingen reaksjon); mens det med et anhydrid, er det en kjemisk forandring, reflektert i molekylstrukturen.
Hvis hydroksidene og syrene sammenlignes med deres tilsvarende oksider (eller anhydrider), vil det sees at det var en reaksjon. På den annen side kan noen oksider eller salter hydratiseres, miste vann og forbli de samme forbindelsene; men uten vann, det vil si vannfritt.
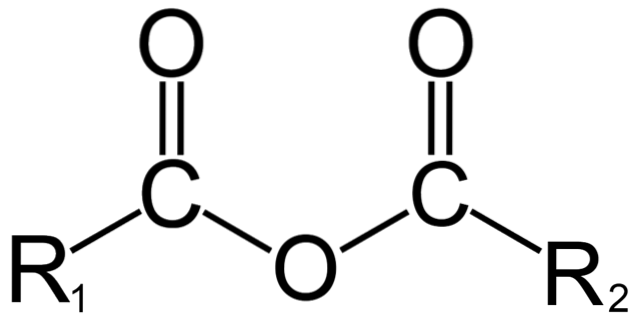
I organisk kjemi, derimot, hva som menes med anhydrid er den første definisjonen. For eksempel er en av de mest kjente anhydridene de som er avledet fra karboksylsyrer (toppbilde). Disse består av foreningen av to acylgrupper (-RCO) gjennom et oksygenatom.
I sin generelle struktur er det indikert R1 for en acylgruppe, og Rto for den andre acylgruppen. Fordi R1 og Rto de er forskjellige, de kommer fra forskjellige karboksylsyrer og det er da et asymmetrisk syreanhydrid. Når begge substituentene R (uansett om de er aromatiske) er like, snakker vi i så fall om et symmetrisk syreanhydrid.
Når to karboksylsyrer binder til dannelse av anhydridet, kan det dannes vann eller ikke, så vel som andre forbindelser. Alt vil avhenge av strukturen til disse syrene.
Artikkelindeks
- 1 Egenskaper av anhydrider
- 1.1 Kjemiske reaksjoner
- 2 Hvordan dannes anhydrider?
- 2.1 Sykliske anhydrider
- 3 Nomenklatur
- 4 Søknader
- 4.1 Organiske anhydrider
- 5 eksempler
- 5.1 Ravsyreanhydrid
- 5.2 Glutarsyrehydrid
- 6 Referanser
Egenskaper av anhydrider
Egenskapene til anhydrider vil avhenge av hvilke du refererer til. Nesten alle av dem har det til felles at de reagerer med vann. Imidlertid, for såkalte basiske anhydrider i uorganisk, er faktisk flere av dem til og med uoppløselige i vann (MgO), så denne uttalelsen vil fokusere for anhydrider av karboksylsyrer.
Smelte- og kokepunkter faller på den molekylære strukturen og intermolekylære interaksjoner for (RCO)toEller dette er den generelle kjemiske formelen for disse organiske forbindelsene.
Hvis molekylmassen til (RCO)toEller den er lav, sannsynligvis en fargeløs væske ved romtemperatur og trykk. For eksempel eddiksyreanhydrid (eller etansyreanhydrid), (CH3CO)toEller det er en væske og den av største industrielle betydning, og produksjonen er veldig stor..
Reaksjonen mellom eddiksyreanhydrid og vann er representert ved følgende kjemiske ligning:
(CH3CO)toO + HtoO => 2CH3COOH
Merk at når vannmolekylet tilsettes, frigjøres to molekyler eddiksyre. Omvendt reaksjon kan imidlertid ikke forekomme for eddiksyre:
2CH3COOH => (CH3CO)toO + HtoO (forekommer ikke)
Det er nødvendig å ty til en annen syntetisk rute. Dikarboksylsyrer, derimot, kan gjøre det ved oppvarming; men det vil bli forklart i neste avsnitt.
Kjemiske reaksjoner
Hydrolyse
En av de enkleste reaksjonene av anhydrider er deres hydrolyse, som nettopp har blitt vist for eddiksyreanhydrid. I tillegg til dette eksemplet er det svovelsyreanhydrid:
HtoStoELLER7 + HtoELLER <=> 2HtoSW4
Her har du et uorganisk syreanhydrid. Merk at for HtoStoELLER7 (også kalt disulfuric acid), reaksjonen er reversibel, så oppvarming av HtoSW4 konsentrat gir opphav til dannelsen av anhydridet. Hvis det derimot er en fortynnet løsning av HtoSW4, SO frigjøres3, svovelsyreanhydrid.
Forestring
Syreanhydrider reagerer med alkoholer, med pyridin i mellom, for å gi en ester og en karboksylsyre. Tenk for eksempel på reaksjonen mellom eddiksyreanhydrid og etanol:
(CH3CO)toO + CH3CHtoOH => CH3COtoCHtoCH3 + CH3COOH
Dermed dannes esteren etyletanoat, CH3COtoCHtoCH3, og etansyre (eddiksyre).
Praktisk sett er det som er substitusjon av hydrogen i hydroksylgruppen, med en acylgruppe:
R1-OH => R1-OCORto
I tilfelle (CH3CO)toEller dens acylgruppe er -COCH3. Derfor sies det at OH-gruppen gjennomgår acylering. Imidlertid er acylering og forestring ikke utskiftbare begreper; acylering kan forekomme direkte på en aromatisk ring, kjent som Friedel-Crafts-acylering.
Alkoholer i nærvær av syreanhydrider forestres således ved acylering.
På den annen side reagerer bare den ene av de to acylgruppene med alkoholen, den andre blir igjen med hydrogenet og danner en karboksylsyre; det for tilfellet med (CH3CO)toEller er etansyre.
Amidasjon
Syreanhydrider reagerer med ammoniakk eller aminer (primære og sekundære) for å gi amider. Reaksjonen er veldig lik forestillingen som nettopp er beskrevet, men ROH erstattes av et amin; for eksempel et sekundært amin, RtoNH.
Igjen, reaksjonen mellom (CH3CO)toO og dietylamin, EttoNH:
(CH3CO)toO + 2EttoNH => CH3CONEtto + CH3COO- +NHtoEtto
Og dietylacetamid, CH3CONEtto, og et karboksylert salt av ammonium, CH3COO- +NHtoEtto.
Selv om ligningen kan virke litt vanskelig å forstå, bare se på hvordan -COCH-gruppen3 erstatte H for et EttoNH for å danne amidet:
EttoNH => EttoNCOCH3
I stedet for å amidere, er reaksjonen fortsatt acylering. Alt er oppsummert i det ordet; denne gangen gjennomgår aminen acylering og ikke alkoholen.
Hvordan dannes anhydrider?
Uorganiske anhydrider dannes ved å reagere elementet med oksygen. Således, hvis elementet er metallisk, dannes et metalloksyd eller basisk anhydrid; og hvis det er ikke-metallisk, dannes et ikke-metallisk oksid eller syreanhydrid.
For organiske anhydrider er reaksjonen annerledes. To karboksylsyrer kan ikke sammenføyes direkte for å frigjøre vann og danne syreanhydrid; deltakelse av en forbindelse som ikke er nevnt ennå er nødvendig: acylklorid, RCOCl.
Karboksylsyren reagerer med acylkloridet og produserer det respektive anhydridet og hydrogenkloridet:
R1COCl + RtoCOOH => (R1CO) ELLER (CORto) + HCl
CH3COCl + CH3COOH => (CH3CO)toO + HCl
A CH3 kommer fra acetylgruppen, CH3CO-, og den andre er allerede til stede i eddiksyre. Valget av et spesifikt acylklorid, så vel som karboksylsyren, kan føre til syntesen av et symmetrisk eller asymmetrisk syreanhydrid.
Sykliske anhydrider
I motsetning til de andre karboksylsyrene som krever acylklorid, kan dikarboksylsyrer kondensere til deres tilsvarende anhydrid. For dette er det nødvendig å varme dem for å fremme frigjøring av HtoO. For eksempel er dannelsen av ftalsyreanhydrid fra ftalsyre vist.

Legg merke til hvordan den femkantede ringen er fullført, og oksygenet som forbinder begge C = O-gruppene er en del av den; dette er et syklisk anhydrid. På samme måte kan det forstås at ftalsyreanhydrid er et symmetrisk anhydrid, siden begge R1 som Rto er identiske: en aromatisk ring.
Ikke alle dikarboksylsyrer er i stand til å danne anhydridet, siden når COOH-gruppene deres er vidt skilt, blir de tvunget til å fullføre større og større ringer. Den største ringen som kan dannes er en sekskantet, større enn at reaksjonen ikke finner sted.
Nomenklatur
Hvordan heter anhydrider? Når man ser bort fra de uorganiske, som er relevante for oksydproblemer, avhenger navnene på organiske anhydrider hittil, avhengig av identiteten til1 og Rto; det vil si av dets acylgrupper.
Hvis de to R-ene er like, erstatter du bare ordet 'syre' med 'anhydrid' i det respektive navnet på karboksylsyren. Og hvis tvert imot de to R-ene er forskjellige, blir de navngitt i alfabetisk rekkefølge. For å vite hva du skal kalle det, må du derfor først se om det er et symmetrisk eller asymmetrisk syreanhydrid.
CH3CO)toO er symmetrisk, siden R1= Rto = CH3. Det stammer fra eddiksyre eller etansyre, så navnet er, etter den forrige forklaringen: eddiksyre eller etansyreanhydrid. Det samme skjer med det nevnte ftalsyreanhydridet.
Anta at vi har følgende anhydrid:
CH3CO (O) COCHtoCHtoCHtoCHtoCHtoCH3
Acetylgruppen til venstre kommer fra eddiksyre, og den til høyre kommer fra heptansyre. For å navngi dette anhydridet må du navngi R-gruppene i alfabetisk rekkefølge. Så navnet er: heptanoeddiksyreanhydrid.
applikasjoner
Uorganiske anhydrider har uendelige bruksområder, fra syntese og formulering av materialer, keramikk, katalysatorer, sementer, elektroder, gjødsel osv. Til et belegg av jordskorpen med tusenvis av jern- og aluminiummineraler, og karbondioksid utåndet av levende organismer.
De representerer startkilden, det punktet hvor mange forbindelser som brukes i uorganiske synteser er avledet. En av de viktigste anhydridene er karbondioksid, COto. Det er, sammen med vann, viktig for fotosyntese. Og på industrielt nivå, SO3 Det er viktig siden den tiltalte svovelsyre oppnås.
Kanskje anhydridet med flest applikasjoner og for å ha (mens det er liv) er en fra fosforsyre: adenosintrifosfat, bedre kjent som ATP, til stede i DNA og "energivalutaen" til metabolisme..
Organiske anhydrider
Syreanhydrider reagerer gjennom acylering, enten til en alkohol, danner en ester, et amin, som gir opphav til et amid eller en aromatisk ring.
Det er millioner av hver av disse forbindelsene, og hundretusener av karboksylsyrealternativer for å lage et anhydrid; derfor vokser de syntetiske mulighetene dramatisk.
Dermed er en av hovedanvendelsene å inkorporere en acylgruppe i en forbindelse, og erstatte et av atomene eller gruppene av dens struktur..
Hvert enkelt anhydrid har sine egne applikasjoner, men generelt reagerer de alle på en lignende måte. Av denne grunn brukes disse typer forbindelser til å modifisere polymere strukturer, og skape nye polymerer; dvs. kopolymerer, harpikser, belegg, etc..
For eksempel brukes eddiksyreanhydrid til å acetylere alle OH-gruppene i cellulose (nedre bilde). Med dette erstattes hvert H av OH med en acetylgruppe, COCH3.
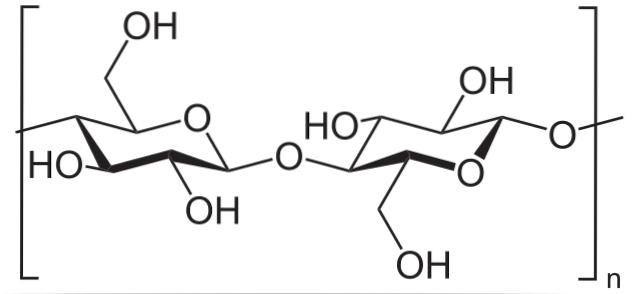
På denne måten oppnås celluloseacetatpolymeren. Den samme reaksjonen kan skisseres med andre polymere strukturer med NH-grupperto, også utsatt for acylering.
Disse acyleringsreaksjonene er også nyttige for syntesen av medikamenter, slik som aspirin (syre) acetylsalisylsyre).
Eksempler
Noen andre eksempler på organiske anhydrider er vist å være ferdige. Selv om det ikke vil bli nevnt noe om dem, kan oksygenatomer erstattes med svovel, noe som gir svovel eller til og med fosforanhydrider..
-C6H5CO (O) COC6H5: benzoesyreanhydrid. Gruppe C6H5 representerer en benzenring. Hydrolysen produserer to benzosyrer.
-HCO (O) COH: maursyreanhydrid. Hydrolysen produserer to maursyrer.
- C6H5CO (O) COCHtoCH3: benzosyre propansyreanhydrid. Hydrolysen produserer benzosyre og propansyre.
-C6HelleveCO (O) COC6Helleve: cykloheksankarboksylsyreanhydrid. I motsetning til aromatiske ringer er disse mettede, uten dobbeltbindinger.
-CH3CHtoCHtoCO (O) COCHtoCH3: propanoic butanoic anhydride.
Ravsyreanhydrid

Her har du en annen syklisk, avledet fra ravsyre, en dikarboksylsyre. Legg merke til hvordan de tre oksygenatomene avslører den kjemiske naturen til denne typen forbindelser.
Maleinsyreanhydrid ligner veldig på ravsyreanhydrid, med den forskjellen at det er en dobbeltbinding mellom karbonene som danner basen av femkant..
Glutarsyreanhydrid
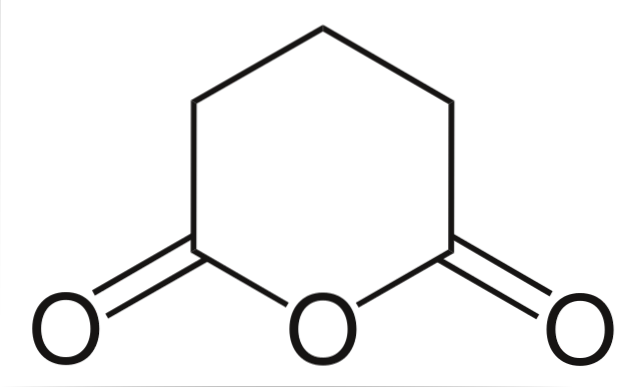
Og til slutt vises glutarsyreanhydrid. Dette skiller seg strukturelt fra alle de andre ved å bestå av en sekskantet ring. Igjen skiller de tre oksygenatomene seg ut i strukturen.
Andre anhydrider, mer komplekse, kan alltid påvises av de tre oksygenatomene nær hverandre.
Referanser
- Redaksjonen av Encyclopaedia Britannica. (2019). Anhydrid. Enclyclopaedia Britannica. Gjenopprettet fra: britannica.com
- Helmenstine, Anne Marie, Ph.D. (8. januar 2019). Syreanhydrid Definisjon i kjemi. Gjenopprettet fra: thoughtco.com
- Kjemi LibreTexts. (s.f.). Anhydrider. Gjenopprettet fra: chem.libretexts.org
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10th utgave.). Wiley pluss.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Morrison og Boyd. (1987). Organisk kjemi. (Femte utgave). Addison-Wesley Iberoamericana.
- Wikipedia. (2019). Organisk syreanhydrid. Gjenopprettet fra: en.wikipedia.org


Ingen har kommentert denne artikkelen ennå.