
Antimonhistorie, struktur, egenskaper, bruksområder og risikoer
De antimon Det er en skinnende, sølvmetalloid med en viss blåaktig fargetone. Det faste stoffet er også preget av å være veldig sprø og flassete i tekstur. Den tilhører gruppe 15 i det periodiske systemet, ledet av nitrogen. Etter vismut (og moscovium) er det det tyngste elementet i gruppen.
Det er representert med det kjemiske symbolet Sb. I naturen finnes det hovedsakelig i mineraler av stibitt og ullmannitt, hvis kjemiske formler er SbtoS3 og NiSbS, henholdsvis. Den høye tendensen til å danne sulfider i stedet for oksider skyldes dets kjemisk myke.

På den annen side er antimon også fysisk mykt, og presenterer en hardhet på 3 på Mohs-skalaen. Den er stabil ved romtemperatur og reagerer ikke med oksygen i luften. Men når det varmes opp i nærvær av oksygen, danner det antimontrioksid, SbtoELLER3.
På samme måte er den motstandsdyktig mot virkningen av svake syrer; men når det er varmt blir det angrepet av salpetersyre og saltsyre.
Antimon har mange anvendelser, blant annet brukes det i legeringer med bly og tinn, til fremstilling av bilbatterier, materialer med lav friksjon, etc..
Denne metalloid har den sjeldne egenskapen at den øker i volum når den stivner, slik at legeringene fullt ut opptar plassen som brukes til å forme instrumentet som skal produseres..
Artikkelindeks
- 1 Oppdagelseshistorie
- 1.1 Før Kristus
- 1.2 Innføring av begrepet
- 1.3 Innhenting
- 2 Struktur av antimon
- 2.1 Allotropia
- 3 eiendommer
- 3.1 Atomvekt
- 3,2 atomnummer
- 3.3 Elektronisk konfigurasjon
- 3.4 oksidasjonstilstander
- 3.5 Fysisk beskrivelse
- 3.6 Smeltepunkt
- 3.7 Kokepunkt
- 3,8 Tetthet
- 3.9 Fusjonsvarme
- 3.10 Fordampningsvarme
- 3.11 Molar varmekapasitet
- 3.12 Elektronegativitet
- 3.13 Atomeradius
- 3.14 Hardhet
- 3.15 Stabilitet
- 3.16 Isotoper
- 3.17 Elektrisk og termisk ledningsevne
- 3.18 Kjemisk reaktivitet
- 4 bruksområder
- 4.1 Legeringer
- 4.2 Brannhemmende
- 4.3 Elektronikkfelt
- 4.4 Medisin og veterinær
- 4.5 Pigmenter og maling
- 4.6 Andre bruksområder
- 5 risikoer
- 6 Referanser
Historien om oppdagelsen
F.Kr.
Det er bevis for at antimon sulfid siden 3100 f.Kr. ble brukt som kosmetikk i Egypt. I Mesopotamia, det nåværende Irak, ble det funnet rester av en vase og en annen gjenstand som antagelig dateres mellom 3000 og 2200 f.Kr., hvor antimon ble brukt i utarbeidelsen.
Innføring av begrepet
Den romerske lærde Plinius den eldre (23-79 e.Kr.) beskrev bruken av antimon, som han kalte stibius, i utarbeidelsen av syv medisiner i sin avhandling om naturhistorie. Alkymisten Abu Mussa Jahir Ibn Hayyan (721-815) er kreditert for å introdusere begrepet antimon for å gi navnet elementet.
Han brukte følgende etymologi: 'anti' som et synonym for negasjon, og 'mono' for bare. Så ønsket han å understreke at antimon ikke bare ble funnet i naturen. Det er allerede kjent at det er en del av sulfidmineraler, så vel som mange andre elementer.
Å skaffe
Det antas at den greske naturisten Pedanius Diascorides har oppnådd rent antimon ved å varme opp antimonsulfid i en luftstrøm. Den italienske metallurg Vannocio Biringucio, i boka De la Pirotecnia (1540), beskriver en metode for å isolere antimon.
Den tyske kjemikeren Andreas Libavius (1615) oppnådde produksjonen av et krystallinsk antimon ved å bruke en smeltet blanding av jern, antimensulfid, salt og kaliumtartrat..
Den første detaljerte rapporten om antimon ble laget i 1707 av den franske kjemikeren Nicolas Lemery (1645-1715), i sin bok Treatise on Antimon.
Antimonstruktur
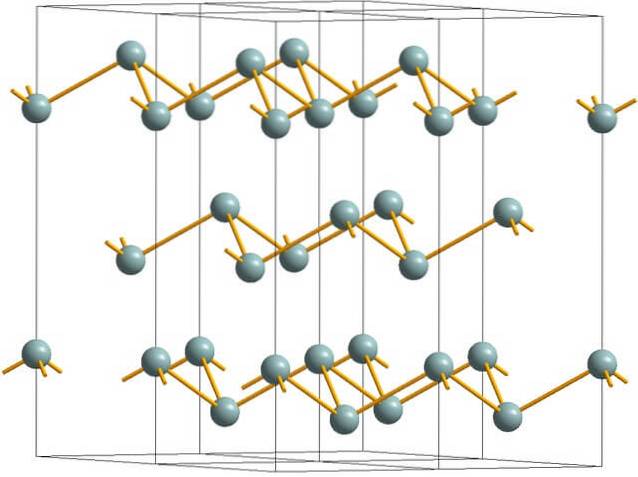
Det øvre bildet viser den rynkete lagdelte strukturen som er adoptert av arsenatomer. Imidlertid vedtar gråaktig antimon, bedre kjent som metallisk antimon, også denne strukturen. Det sies å være "krøllete" fordi det er Sb-atomer som stiger og faller fra planet som består av laget.
Disse lagene, selv om de er ansvarlige for fotonene som samhandler med den, skinner sølvfargede skinner og får antimon til å passere som et metall, men sannheten er at kreftene som forener dem er svake; dermed kan de tilsynelatende metallfragmentene av Sb lett males og sprø eller flassete.
Sb-atomene i de rynkede lagene er heller ikke nær nok til å gruppere sine atomorbitaler for å skape et bånd som tillater elektrisk ledning..
Ser man på en grå sfære hver for seg, kan man se at den har tre Sb-Sb obligasjoner. Fra et høyere plan kunne Sb sees i midten av en trekant, med tre Sb plassert i toppunktene. Trekanten er imidlertid ikke flat og har to nivåer eller etasjer..
Den laterale reproduksjonen av slike trekanter og deres bånd etablerer rynkete lag, som strekker seg opp for å danne rombohedriske krystaller..
Allotropi
Den nettopp beskrevne strukturen tilsvarer gråaktig antimon, den mest stabile av de fire allotropene. De tre andre allotropene (svart, gul og eksplosiv) er metastabile; det vil si at de kan eksistere under veldig tøffe forhold.
Det er ikke mye informasjon om strukturene deres. Det er imidlertid kjent at svart antimon er amorft, så strukturen er rotete og intrikat..
Gult antimon er stabilt under -90 ° C, oppfører seg som et ikke-metallisk element, og kan antas å bestå av små agglomerater av Sb-type4 (ligner på fosfor); når den varmes opp forvandles den til den svarte allotropen.
Og når det gjelder eksplosivt antimon, består det av en gelatinøs avsetning dannet på katoden under elektrolyse av en vandig løsning av et antimonhalogenid..
Ved den minste sterke friksjon eller støt frigjør det myke faste stoffet så mye varme at det eksploderer og stabiliserer seg når atomene samles i den rombohedriske krystallstrukturen til gråaktig antimon..
Eiendommer
Atomvekt
121,76 g / mol.
Atomnummer
51.
Elektronisk konfigurasjon
[Kr] 4d105sto5 s3.
Oksidasjonstilstander
-3, -2, -1, +1, +2, +3, +4, +5.
Fysisk beskrivelse
Lys sølv solid, sprø, med en skjellende overflate, med en blåaktig fargetone. Det kan også fremstå som et svart pulver.
Smeltepunkt
630,63 ºC.
Kokepunkt
1.635 ºC.
Tetthet
-6,697 g / cm3 i romtemperatur.
-6,53 g / cm3 i flytende tilstand, temperatur lik eller større enn smeltepunktet.
Fusjonsvarme
19,79 kJ / mol.
Fordampningsvarme
193,43 kJ / mol.
Molar varmekapasitet
25,23 J / mol.K
Elektronegativitet
2.05 (Pauling skala).
Atomic radio
140.00.
Hardhet
Det er et mykt element, med en hardhet på 3 på Mohs-skalaen og kan skrapes av glass.
Stabilitet
Den er stabil ved romtemperatur og opplever ikke oksidasjon. Det er også motstandsdyktig mot syreangrep.
Isotoper
Den har to stabile isotoper: 121Sb og 123Sb. I tillegg er det 35 radioaktive isotoper. Den radioaktive isotopen 125Sb er den med lengst halveringstid: 2,75 år. Generelt avgir radioaktive isotoper β-stråling+ og β-.
Elektrisk og termisk ledningsevne
Antimon er en dårlig leder av varme og elektrisitet.
Kjemisk reaktivitet
Det kan ikke fortrenge hydrogen fra fortynnede syrer. Danner ioniske komplekser med organiske og uorganiske syrer. Metallisk antimon reagerer ikke med luft, men blir raskt omdannet til oksid i fuktig luft..
Halogener og sulfider oksiderer lett antimon hvis prosessen skjer ved forhøyede temperaturer.
applikasjoner
Legeringer
Antimon brukes i en legering med bly for å lage plater til bilbatterier, noe som forbedrer motstanden til platene, samt karakteristikken til ladningene..
Legeringen med bly og tinn har blitt brukt til å forbedre egenskapene til sveiser, så vel som for tracer-kuler og patron-detonatorer. Den brukes også i legeringer for belegg av elektriske kabler..
Antimon brukes i antifriksjonslegeringer, til fremstilling av tinn og herdende legeringer med lavt tinninnhold ved fremstilling av orgeler og andre musikkinstrumenter..
Den har det karakteristiske, delt med vann, av å øke i volum når det kondenserer; Derfor fyller antimonet som er tilstede i legeringene med bly og tinn alle rom i formene, og forbedrer definisjonen av strukturene laget med legeringene..
Brannhemmende
Antimontrioksid brukes til å lage brannhemmende forbindelser, alltid i kombinasjon med halogenerte brannhemmere, bromider og klorider..
Brannhemmere kan reagere med oksygenatomer og OH-radikaler, noe som hemmer brann. Disse flammehemmere brukes i barneklær, leker, fly og i bilseter.
De tilsettes også i polyesterharpikser og i glassfiberkompositter for gjenstander som brukes som deksler til lette flymotorer..
Antimonforbindelser som brukes som brannhemmende midler inkluderer: antimonoksyklorid, SbOCl; antimonpentoksid, SbO5; antimontriklorid, SbCl3; og antimontrioksid, SbO3.
Elektronikkfelt
Den brukes til fremstilling av halvledere, dioder, midt-infrarøde detektorer og til fremstilling av transitorer. Antimon med høy renhet, brukt i halvlederteknologi, oppnås ved å redusere antimonforbindelser med hydrogen.
Medisin og veterinær
Antimonforbindelser har blitt brukt i medisin siden antikken som emetika og antiprotozoer. Kaliumkaliumtartrat (tartaremetic) ble brukt som et antischistosom i lang tid; blir brukt i tillegg som en slimløsende, diaphoretic og emetic.
Antimonsalter har også blitt brukt til kondisjonering av huden hos drøvtyggere. slik som aniomalin og litiumantimontiomalat.
Meglumine antimoniate er et medikament som brukes til behandling av leishmaniasis i eksterne foci hos husdyr. Selv om de terapeutiske fordelene var begrensede.
Pigmenter og maling
Antimonforbindelser brukes til fremstilling av maling og opacifier i emaljer. De brukes også i vermilion, gule og oransje pigmenter, som er produkter av langsom oksidasjon av antimonsulfider..
Noen av dets organiske salter (tartrater) brukes i tekstilindustrien for å hjelpe til med å binde visse fargestoffer.
Antimensulfid ble brukt i det gamle Egypt som et kosmetisk middel for å gjøre øynene mørkere.
Andre bruksområder
Noen antimonsalter brukes som belegningsmidler for å fjerne mikroskopiske bobler som dannes på TV-skjermer. Antimonioner samhandler med oksygen, og eliminerer dens tendens til å danne bobler.
Antimon (III) sulfid brukes i hodene på noen sikkerhetskamper. Antimonsulfid brukes også til å stabilisere friksjonskoeffisienten til materialer som brukes i bilbremseklosser..
Isotop 124Sb, sammen med beryllium, brukes som en nøytronkilde, med et energisnitt på 24 keV. I tillegg brukes antimon som en katalysator i produksjonen av plast..
Risiko
Det er et sprøtt element, slik at forurensende støv fra miljøet kan produseres under håndteringen. Hos arbeidstakere som er utsatt for antimonstøv, er dermatitt, renitt, betennelse i øvre luftveier og konjunktivitt observert.
Pneumokoniose, noen ganger kombinert med obstruktive lungeforandringer, er beskrevet etter langvarig eksponering.
Antimontrioksid kan forårsake livstruende skade på hjertefunksjonen.
Hos personer som er utsatt for dette elementet, har det blitt observert tilstedeværelsen av forbigående pustulære hudinfeksjoner..
Kontinuerlig inntak av lave doser av dette metallet kan forårsake diaré, oppkast og magesår. På samme måte er den maksimale tolerable konsentrasjonen i luft 0,5 mg / m3.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Manny. (11. mars 2009). Gult antimon og eksplosivt antimon. Gjenopprettet fra: antimonyproperties.blogspot.com
- Prof. Ernst Cohen og J. C. Van Den Bosch. (1914). Antotimens allotropi. Proceedings Royal Acad. Amsterdam. Vol. XVII.
- Wikipedia. (2019). Antimon. Gjenopprettet fra: en.wikipedia.org
- Advameg, Inc. (2019). Antimon. Gjenopprettet fra: chemistryexplained.com
- Sable Mc'Oneal. (15. september 2018). Kjemi: egenskaper og anvendelse av Sb-Antimon. Gjenopprettet fra: medium.com



Ingen har kommentert denne artikkelen ennå.