
Arsen historie, struktur, egenskaper, bruksområder
De arsenikk Det er en halvmetall eller metalloid som tilhører gruppe 15 eller VA i det periodiske systemet. Den er representert med det kjemiske symbolet As, og atomnummeret er 33. Det finnes i tre allotrope former: gul, svart og grå; sistnevnte er den eneste med industriell betydning.
Grå arsen er et sprøtt, metallisk fast stoff med en stål, krystallinsk farge (bildet nedenfor). Den mister glansen når den utsettes for luft og danner arsenoksid (AstoELLER3), som ved oppvarming avgir en hvitløkslukt. På den annen side er de gule og svarte allotropene henholdsvis molekylære og amorfe..

Arsen finnes i jordskorpen assosiert med mange mineraler. Bare en liten andel finnes i den opprinnelige staten, men assosiert med antimon og sølv.
Blant de vanligste mineralene der arsen finnes, er følgende: realgar (As4S4), orpimentet (AstoS3), loellingite (FeAsto) og enargitt (Cu3AsS4). Arsen oppnås også som et biprodukt fra smelting av metaller som bly, kobber, kobolt og gull..
Arsenforbindelser er giftige, spesielt arsin (AsH3). Imidlertid har arsen mange industrielle anvendelser, inkludert legering med bly, brukt til fremstilling av bilbatterier, og legering med gallium med forskjellige bruksområder innen elektronikk..
Artikkelindeks
- 1 Oppdagelseshistorie
- 2 Struktur av arsen
- 2.1 Gul arsen
- 2.2 Svart arsen
- 3 Elektronisk konfigurasjon
- 4 eiendommer
- 4.1 Molekylvekt
- 4.2 Fysisk beskrivelse
- 4.3 Farge
- 4.4 Lukt
- 4.5 Smak
- 4.6 Smeltepunkt
- 4.7 Tetthet
- 4.8 Løselighet i vann
- 4.9 Atomeradius
- 4.10 Atomvolum
- 4.11 Kovalent radius
- 4.12 Spesifikk varme
- 4.13 Fordampningsvarme
- 4.14 Elektronegativitet
- 4.15 Ioniseringsenergi
- 4.16 oksidasjonstilstander
- 4.17 Stabilitet
- 4.18 Nedbrytning
- 4.19 Selvantennelse
- 4.20 Hardhet
- 4.21 Reaktivitet
- 5 bruksområder
- 5.1 Legeringer
- 5.2 Elektronikk
- 5.3 Jordbruk og trevern
- 5.4 Legemidler
- 5.5 Andre bruksområder
- 6 Hvor er?
- 7 Hvordan får du det?
- 8 Referanser
Historien om oppdagelsen
Navnet "arsen" kommer fra det latinske arsenicum og det greske arsenikonet, med henvisning til gul orpiment, som var den viktigste formen for bruk av arsen av alkymister..
Arsen, lenge før den ble anerkjent som et kjemisk element, var kjent og brukt i form av forbindelsene. For eksempel Aristoteles i det 4. århundre f.Kr. skrev om sandarache, et stoff som nå antas å være arseniksulfid.
Plinius den eldre og Pedanius Discórides, i det 1. århundre e.Kr., beskrev orpimentet, et mineral bestående av AstoS3. I det 11. århundre ble tre arter av arsen anerkjent: hvit (As4ELLER4), den gule (AstoS3) og rød (As4S4).
Arsen som et rent element ble først observert av Albertus Magnus (1250). Magnus oppvarmet arsen sulfid med såpe, og la merke til utseendet til et stoff med en karakteristikk som ligner den gråaktige allotropen i bildet. Imidlertid ble den første autentiske rapporten om isolasjonen hans publisert i 1649 av en tysk farmasøyt Johann Schroeder..
Schroeder forberedte arsenet ved å varme opp oksidet med kull. Deretter klarte Nicolas Lémery å produsere den ved å varme opp en blanding av arsenoksid, såpe og kaliumchlorid. På 1700-tallet ble dette elementet endelig anerkjent som et halvmetall.
Struktur av arsen
Arsen er isomorf til antimon; det vil si at de er strukturelt identiske, og avviker bare i størrelsen på deres atomer. Hvert arsenatom danner tre kovalente bindinger As-As, på en slik måte at de stammer fra sekskantede enheter As6 “Rynket eller bratt”, siden hybridiseringen av As-atomer er sp3.
Så enhetene As6 de kobler sammen og gir opphav til rene lag med arsen, som samhandler svakt med hverandre. På grunn av deres intermolekylære krefter, avhengig av alt av atommassene, gir romboedriske grå arsenkrystaller det faste stoffet en skjør og sprø tekstur..
Muligens på grunn av frastøting av det frie elektronparet arsen, As6 dannet mellom parallelle lag definerer ikke en perfekt, men forvrengt oktaeder:
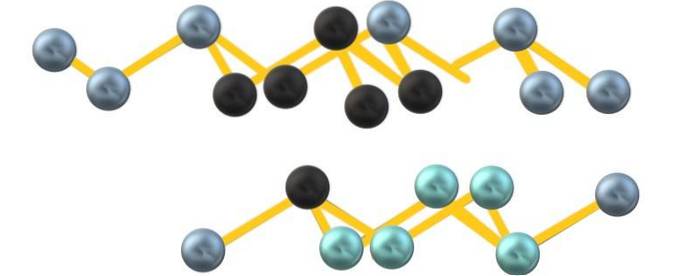
Merk at de svarte kulene tegner det forvrengte planet i rommet mellom to bratte lag. På samme måte er det i laget under blåkuler som sammen med den svarte kule utgjør enheten som6 nevnt i begynnelsen av avsnittet.
Strukturen ser ordnet ut, radene går opp og ned, og derfor er den krystallinsk. Imidlertid kan det bli amorft, med kuler presset på forskjellige måter. Når gråaktig arsen blir amorf, forvandles det til en halvleder.
Gul arsen
Gul arsen, den giftigste allotropen til dette elementet, er et rent molekylært fast stoff. Den består av molekyler av As4 enheter med svake spredningskrefter, som ikke hindrer dem i å fordampe.
Svart arsen
Svart arsen er amorf; men ikke hvordan den gråaktige allotropen kan være. Dens struktur er litt lik den som nettopp er beskrevet, med forskjellen at dens plan av enheter As6 har større områder og forskjellige mønstre av rot.
Elektronisk konfigurasjon
[Ar] 3d104sto4p3
Den har alle nivå 3 orbitaler fylt. Danner obligasjoner ved hjelp av 4s og 4p orbitaler (akkurat som 4d) gjennom forskjellige kjemiske hybridiseringer.
Eiendommer
Molekylær vekt
74,922 g / mol
Fysisk beskrivelse
Grå arsen er et gråaktig fast stoff med metallisk utseende og en sprø konsistens..
Farge
Tre allotrope former, gul (alfa), svart (beta) og grå (gamma).
Lukt
Toalett
Smak
Smakløs
Smeltepunkt
1090 K ved 35,8 atm (trippelpunkt for arsen).
Ved normalt trykk har den ikke noe smeltepunkt, da det sublimerer til 887 K.
Tetthet
-Grå arsen: 5,73 g / cm3.
-Gul arsen: 1,97 g / cm3.
Vannløselighet
Uoppløselig
Atomic radio
139 pm
Atomisk volum
13,1 cm3/ mol
Kovalent radius
120.00
Spesifikk varme
0,328 J / gmol ved 20 ° C
Fordampningsvarme
32,4 kJ / mol
Elektronegativitet
2.18 på Pauling-skalaen
Ioniseringsenergi
Første ioniseringsenergi 946,2 kJ / mol
Oksidasjonstilstander
-3, +3, +5
Stabilitet
Elementært arsen er stabilt i tørr luft, men når det utsettes for fuktig luft blir det dekket av et bronsegult lag som kan bli et svart lag av arsenoksid (AstoELLER3).
Nedbrytning
Når arsen oppvarmes til nedbrytning, avgir den hvit røyk av AstoELLER3. Fremgangsmåten er farlig fordi arsine, en veldig giftig gass, også kan frigjøres.
Selvantennelse
180 ºC
Hardhet
3,5 på Mohs hardhetsskala.
Reaktivitet
Det blir ikke angrepet av kald svovelsyre eller konsentrert saltsyre. Reagerer med varm salpetersyre eller svovelsyre og danner arseninsyre og arseninsyre.
Når grå arsen blir fordampet ved oppvarming, og dampene raskt avkjøles, dannes en gul arsen. Dette går tilbake til den grålige formen når den utsettes for ultrafiolett lys.
applikasjoner
Legeringer
En liten mengde arsen tilsatt for bly, herder legeringene nok til å bruke dem i belegg av kabler og til fremstilling av bilbatterier..
Tilsetningen av arsen til messing, en legering av kobber og sink, øker korrosjonsmotstanden. På den annen side korrigerer eller reduserer det tapet av sink i messingen, noe som medfører en økning i levetiden..
elektronikk
Renset arsen brukes i halvlederteknologi der den brukes sammen med gallium og germanium, så vel som i form av galliumarsenid (GaAs) som er den nest mest brukte halvlederen.
GaAs har et direkte båndgap, som kan brukes i diode-, laser- og LED-produksjon. I tillegg til galliumarsenid er det andre arsenider, slik som indiumarsenid og aluminiumarsenid, som også er III-V halvledere..
I mellomtiden er kadmiumarsenid en type II-IV halvleder. Arsine har blitt brukt i doping av halvledere.
Jordbruk og trevern
De fleste av applikasjonene er blitt skrotet på grunn av deres høye toksisitet og forbindelsene. EssettoELLER3 har blitt brukt som et plantevernmiddel, mens AstoELLER5 er en ingrediens i herbicider og insektmidler.
Arseninsyre (H3AsO4) og salter som kalsiumarsenat og blyarsenat har blitt brukt til å sterilisere jord og bekjempe skadedyr. Dette skaper en risiko for miljøforurensning med arsen..
Blyarsenat ble brukt som insektmiddel på frukttrær frem til første halvdel av 1900-tallet. Men på grunn av toksisiteten ble den erstattet av natriummetylarsenat, som sluttet å bli brukt av samme grunn siden 2013.
Medisinsk
Fram til det 20. århundre ble flere av forbindelsene brukt som medisiner. Arsphenamine og neolsalvarsan, for eksempel, har blitt brukt i behandlingen av syfilis og trypanosomiasis.
I 2000 ble bruken av AstoELLER3, Meget giftig forbindelse, ved behandling av akutt promyelocytisk leukemi resistent mot all-trans retinsyre. Nylig ble den radioaktive isotopen brukt 74Ess for tumorlokalisering.
Isotopen gir gode bilder, klarere enn de som oppnås med 124Jeg, fordi jod bæres til skjoldbruskkjertelen og produserer støy i signalet.
Andre bruksområder
Arsen ble tidligere brukt som tilsetningsstoff i fjørfe- og griseproduksjon.
Det brukes som en katalysator ved fremstilling av etylenoksid. Den brukes også i fyrverkeri og garvning. Arsenoksid brukes som avfargingsmiddel ved fremstilling av glass.
Hvor befinner det seg?
Arsen kan finnes i små mengder i elementær tilstand, med høy grad av renhet. Den er til stede i mange forbindelser, som: sulfider, arsenider og sulfoarseniider.
Det finnes også i flere mineraler, inkludert: arsenopyritt (FeSAs), loellingite (FeAs)to), enargitt (Cu3AsS4), orpimentet (AstoS3) og realgar (As4S4).
Hvordan oppnås det?
Arsenopyritt varmes opp til 650-700 ° C, i fravær av luft. Arsenet fordamper, og etterlater jernsulfid (FeS) som en rest. Under denne prosessen forbinder arsen oksygen for å danne As4ELLER6, kjent som "hvit arsen".
Esset4ELLER6 er modifisert for å danne AstoELLER3, hvis damp samles og kondenseres i et sett med mursteinskamre, hvor arsenen blir renset ved sublimering.
Det meste av arsen produseres ved å redusere karbon av støvet dannet fra AstoELLER3.
Referanser
- Stephen R. Marsden. (23. april 2019). Kjemi av arsen. Kjemi LibreTexts. Gjenopprettet fra: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (3. desember 2018). Interessante fakta om arsen. Gjenopprettet fra: thoughtco.com
- Wikipedia. (2019). Arsenikk. Gjenopprettet fra: en.wikipedia.org
- Dr. Dough Stewart. (2019). Fakta om arsenelement. Chemicool. Gjenopprettet fra: chemicool.com
- Royal Society of Chemistry. (2019). Arsenikk. Gjenopprettet fra: rsc.or
- Redaksjonen av Encyclopaedia Britannica. (3. mai 2019). Arsenikk. Encyclopædia Britannica. Gjenopprettet fra: britannica.com



Ingen har kommentert denne artikkelen ennå.