
Beryllium historie, struktur, egenskaper, bruksområder
De beryllium Det er et metallisk element som tilhører gruppe 2 eller IIA i det periodiske systemet. Det er det letteste jordalkalimetallet i gruppen, og er representert med symbolet Be. Dens atom og kation er også mindre enn dets kongenere (Mg, Ca, Sr ...).
På grunn av sin uvanlige ladetetthet forekommer dette metallet vanligvis ikke isolert. Det er kjent at det er rundt 30 mineraler som inneholder det, blant annet: beryl (3BeOAltoELLER36SiOto2HtoO), bertranditt (4BeO.2SiOto.2HtoO), chrysoberyl (BeAltoELLER4) og fenaquita (BetoJa4).

Smaragd, en edelsten, er en variant av beryl. Imidlertid er rent beryllium ikke så slående; den har blekgrå glitter (toppbilde), og har blitt oppnådd i form av frø eller pastiller.
Beryllium har et sett med karakteristiske fysiske egenskaper. Den har lav tetthet; høye termiske og elektriske ledninger, så vel som dens termiske kapasitet og varmespredning; det er ikke et magnetisk metall; og har også en passende kombinasjon av stivhet og elastisitet.
Alle disse egenskapene har ført til at beryllium er et metall med mange anvendelser, alt fra bruk i legeringer med kobber til fremstilling av verktøy, til bruk i raketter, fly, biler, atomreaktorer, røntgenutstyr, resonans kjernemagnetisk, etc.
Beryllium har 10 kjente isotoper, alt fra 5Vær en 14Vær, være 9Vær den eneste stabile. På samme måte er det et veldig giftig metall, som spesielt påvirker luftveiene, så det er en begrensning i bruken..
Artikkelindeks
- 1 Oppdagelseshistorie
- 2 Struktur av beryllium
- 3 Elektronisk konfigurasjon
- 4 eiendommer
- 4.1 Fysisk beskrivelse
- 4.2 Smeltepunkt
- 4.3 Kokepunkt
- 4.4 Tetthet
- 4.5 Atomeradius
- 4.6 Kovalent radius
- 4.7 Atomvolum
- 4.8 Spesifikk varme
- 4.9 Fusjonsvarme
- 4.10 Fordampningsvarme
- 4.11 Elektronegativitet
- 4.12 Standardpotensial
- 4.13 Lydens hastighet
- 4.14 Termisk ekspansjon
- 4.15 Varmeledningsevne
- 4.16 Kjemiske egenskaper
- 5 Søknader
- 5.1 Utvikling av verktøy
- 5.2 Lage speil
- 5.3 I ioniserende stråling
- 5.4 I magnetismegenererende utstyr
- 5.5 Atomreaktorer
- 5.6 Metallbeskytter
- 6 Hvor er?
- 7 Risiko
- 8 Referanser
Historien om oppdagelsen
Beryllium ble oppdaget av Louis-Nicolas Vauguelin i 1798 som et komposisjonselement av mineralet beryl, og et silikat av aluminium og beryllium.
Senere lyktes den tyske kjemikeren Frederic Wöhler, i 1828, å isolere beryllium ved å reagere kalium med berylliumklorid i en platina-digel..
Samtidig og uavhengig oppnådde den franske kjemikeren Antoine Bussy også isolasjonen av beryllium. Wöhler var den første som foreslo navnet beryllium for metallet.
Det fikk sitt nåværende navn i 1957, siden det tidligere var kjent som glukinium, på grunn av den søte smaken av noen av saltene. Men for å unngå forveksling med andre søtsmakende forbindelser, og med en plante som heter glukin, ble det besluttet å endre navn til beryllium..
Struktur av beryllium
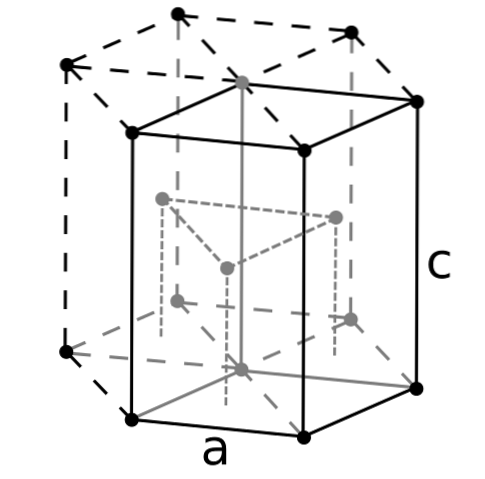
Beryllium er det letteste av jordalkalimetallene, og det må forventes at volumet av atomene er det minste av alle. Berylliumatomer samhandler med hverandre gjennom metallbindingen, på en slik måte at deres "hav av elektroner" og frastøtingene mellom kjernene former strukturen til det resulterende krystallet..
De svarte krystallene av beryllium dannes deretter. Disse krystallene har en sekskantet struktur (øvre bilde), hvor hvert Be-atom har seks naboer, og ytterligere tre i planene over og under..
Siden krystallene er svarte, er det nyttig å forestille seg at de svarte punktene i den sekskantede strukturen erstattes av berylliumatomer. Dette er en av de mest kompakte konstruksjonene som et metall kan vedta; og det er fornuftig at de veldig små atomene i Be blir "klemt" så mye for å unngå minst mulig tomrom eller antall hull mellom dem.
Elektronisk konfigurasjon
1sto2sto
Som er lik 4 elektroner, hvorav 2 er av valens. Hvis et elektron blir promotert til 2p-orbitalen, vil vi ha to sp-hybridorbitaler. Således kan det i berylliumforbindelser være lineære geometrier, X-Be-X; for eksempel det isolerte molekylet av BeClto, Cl-Be-Cl.
Eiendommer
Fysisk beskrivelse
Blank, sprø, stålgrå solid.
Smeltepunkt
1287 ºC.
Kokepunkt
2471 ºC.
Tetthet
- 1,848 g / cm3 i romtemperatur.
- 1,69 g / cm3 til smeltepunkt (flytende tilstand).
Atomic radio
112.00.
Kovalent radius
90.00.
Atomisk volum
5 cm3/ mol.
Spesifikk varme
1824 J / gmol ved 20 ºC.
Fusjonsvarme
12,21 kJ / mol.
Fordampningsvarme
309 kJ / mol.
Elektronegativitet
1,57 på Pauling-skalaen.
Standardpotensial
1,70 V.
Lydens hastighet
12.890 m / s.
Termisk ekspansjon
11,3 µm / m K ved 25 ºC.
Termisk ledningsevne
200 w / m K.
Kjemiske egenskaper
Beryllium er belagt med et lag med berylliumoksid (BeO) som beskytter det i luft ved romtemperatur. Oksidasjonen av beryllium skjer ved temperaturer over 1000 ºC, med opprinnelse som produkter berylliumoksid og berylliumnitrid.
Den er også motstandsdyktig mot virkningen av salpetersyre 15 M. Men den oppløses i saltsyre og baser, slik som natriumhydroksid..
applikasjoner
Verktøyproduksjon
Beryllium danner legeringer med kobber, nikkel og aluminium. Spesielt produserer legeringen med kobber verktøy med stor hardhet og motstand, og utgjør bare 2% av legeringen..
Disse verktøyene produserer ikke gnister når de treffer jern, noe som gjør at de kan brukes i miljøer med høyt innhold av brennbare gasser..
På grunn av den lave tettheten har den en lett vekt, som sammen med sin stivhet tillater bruk i romfly, raketter, missiler og fly. Legeringen med beryllium har blitt brukt til fremstilling av bildeler. Det har også blitt brukt i produksjon av fjærer.
På grunn av den store hardheten som beryllium gir legeringer, har de blitt brukt i bremsene på militære fly.
Speilskaping
Beryllium har blitt brukt i produksjonen av speil på grunn av dens dimensjonsstabilitet og dets evne til å være høyt polert. Disse speilene brukes i satellitter og i brannkontrollsystemer. I tillegg brukes de i romteleskoper.
I ioniserende stråling
Beryllium er et element med lav tetthet, så det kan anses å være gjennomsiktig for røntgenstråler. Denne karakteristikken tillater bruk i konstruksjonen av vinduene i rørene som produserer røntgenstråler, til industriell bruk og til medisinsk diagnose..
Beryllium brukes også i vinduene til radioaktive utslippsdetektorer..
I magnetismegenererende utstyr
Blant egenskapene til beryllium er at det ikke er et magnetisk element. Dette gjør at den kan brukes i konstruksjonen av artikler av magnetisk resonansutstyr, der magnetiske felt med høy intensitet genereres, noe som minimerer forstyrrelser.
Atomreaktorer
På grunn av det høye smeltepunktet har den funnet anvendelse i atomreaktorer og keramikk. Beryllium brukes som moderator for kjernefysiske reaksjoner og som produsent av nøytroner:
9Være + 4Han (α) => 12C + n (nøytron)
Det anslås at det produseres opptil 30 millioner nøytroner for en million berylliumatomer som bombes med α-partikler. Nettopp denne kjernefysiske reaksjonen tillot oppdagelsen av nøytronet.
James Chadwick bombarderte berylliumatomer med α (He) -partikler. Forskeren observerte frigjøring av subatomære partikler, uten elektrisk ladning, noe som førte til oppdagelsen av nøytroner.
Metallbeskytter
Å tilsette en mengde beryllium på overflaten av metaller som kan oksideres, gir dem en viss beskyttelse. For eksempel reduseres brennbarheten til magnesium og glansen av sølvlegeringer forlenges.
Hvor befinner det seg?
Beryl finnes i pegmatitt, assosiert med glimmer, feltspat og kvarts. Ved å bruke flotasjonsteknikk skilles en blanding av beryl og feltspat. Deretter konsentreres feltspat og beryl og behandles med kalsiumhypokloritt..
Etterfulgt av en behandling med svovelsyre og kaliumsulfonat, ved hjelp av en fortynning, oppnås flytingen av beryl, som skiller den fra feltspat.
Beryl behandles med natriumfluorosilikat og brus ved 770 ° C for å danne natriumfluorobylat, aluminiumoksid og silisiumdioksid. Berylliumhydroksyd blir deretter utfelt fra natriumfluoroberylatoppløsningen med natriumhydroksid.
Berylliumfluorid dannes ved å omsette berylliumhydroksid med ammoniakkhydrogenfluorid og produsere ammoniumtetrafluroberylat. Denne varmes opp for å danne berylliumfluorid, som varmebehandles med magnesium for å isolere berylliumet..
Risiko
Beryllium som et finfordelt metall, i form av løsninger, tørt pulver eller røyk, er veldig giftig og kan forårsake dermatitt. Imidlertid er den største toksisiteten produsert ved innånding.
Opprinnelig kan beryllium indusere en overfølsomhet eller allergi, som kan utvikle seg til berylliose eller kronisk berylliumsykdom (CBD). Dette er en alvorlig sykdom, preget av en reduksjon i lungekapasiteten.
Akutt sykdom er sjelden. Ved kronisk sykdom dannes granulomer i hele kroppen, spesielt i lungene. Kronisk berylliose forårsaker progressiv dyspné, hoste og generell svakhet (asteni).
Akutt berylliose kan være dødelig. I berylliose oppstår det gradvise tapet av luftveisfunksjon, siden det er hindring i strømmen av gasser i luftveiene og redusert oksygenering av arterieblodet..
Referanser
- Royal Society of Chemistry. (2019). Beryllium. Gjenopprettet fra: rsc.org
- Nasjonalt senter for bioteknologisk informasjon. (2019). Beryllium. PubChem-database. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Helmenstine, Anne Marie, Ph.D. (15. mars 2019). Beryllium Fakta. Gjenopprettet fra: thoughtco.com
- Wikipedia. (2019). Beryllium. Gjenopprettet fra: en.wikipedia.org
- Lenntech B. V. (2019). Beryllium-Be. Gjenopprettet fra: lenntech.com
- Materio Corporation. (2019). Lær om elementet beryllium Gjenopprettet fra: beryllium.com
- D. Michaud. (2016, 12. april). Beryllium prosessering og utvinning problem. 911 Metallurg. Gjenopprettet fra: 911metallurgist.com
- Timothy P. Hanusa. (5. januar 2016). Beryllium. Encyclopædia Britannica. Gjenopprettet fra: britannica.com
- Lee S. Newman. (2014). Beryllium sykdom. MSD Manual. Gjenopprettet fra: msdmanuals.com



Ingen har kommentert denne artikkelen ennå.