
Butino struktur, egenskaper og bruksområder

De butino er en kjemisk forbindelse som tilhører gruppen alkyner, karakterisert hovedsakelig av å ha i strukturen minst en trippelbinding mellom to karbonatomer.
Når det gjelder å etablere regler for navngivning av alkyner, har IUPAC (International Union of Pure and Applied Chemistry) slått fast at de samme reglene brukes som for alkener..

Den grunnleggende forskjellen mellom nomenklaturen for begge typer stoffer er at endelsen -eno endres til -ino når det gjelder forbindelser som har trippelbindinger i strukturen..
På den annen side består butyne utelukkende av karbon og hydrogen, og forekommer i to former: 1-butyne, som er i gassfasen under standard trykk- og temperaturforhold (1 atm, 25 ° C); og 2-butyne, som er en art i flytende fase produsert ved kjemisk syntese.
Artikkelindeks
- 1 Kjemisk struktur
- 1.1 1-butyne
- 1.2 2-butyne
- 2 eiendommer
- 3 bruksområder
- 4 Referanser
Kjemisk struktur
I molekylet kjent som butyne, forekommer fenomenet strukturell posisjonsisomerisme, som består av tilstedeværelsen av de samme funksjonelle gruppene i begge forbindelser, men hver av disse finnes på et annet sted i kjeden..
I dette tilfellet har begge former for butyne en identisk molekylformel; imidlertid i 1-butyne er trippelbindingen plassert på karbon nummer én, mens den i 2-butyne ligger på nummer to. Dette omdanner dem til posisjonsisomerer.
På grunn av plasseringen av trippelbindingen i en av terminalene til 1-butynstrukturen, regnes den som en terminal alkyn, mens den mellomliggende posisjonen til trippelbindingen i 2-butynstrukturen gir den klassifiseringen av intern alkyn..
Dermed kan bindingen bare være mellom første og andre karbon (1-butyn) eller mellom det andre og tredje karbon (2-butyne). Dette skyldes nomenklaturen som brukes, hvor lavest mulig nummerering alltid vil bli gitt til posisjonen til trippelbindingen..
1-butyne
Forbindelsen kalt 1-butyne er også kjent som etylacetylen, på grunn av dens struktur og måten de fire karbonatomer er ordnet og bundet på. Imidlertid når du snakker om butino referanse er kun henvist til denne kjemiske arten.
I dette molekylet er trippelbindingen ved et terminal karbon, som tillater tilgjengeligheten av hydrogenatomer som gir den stor reaktivitet.
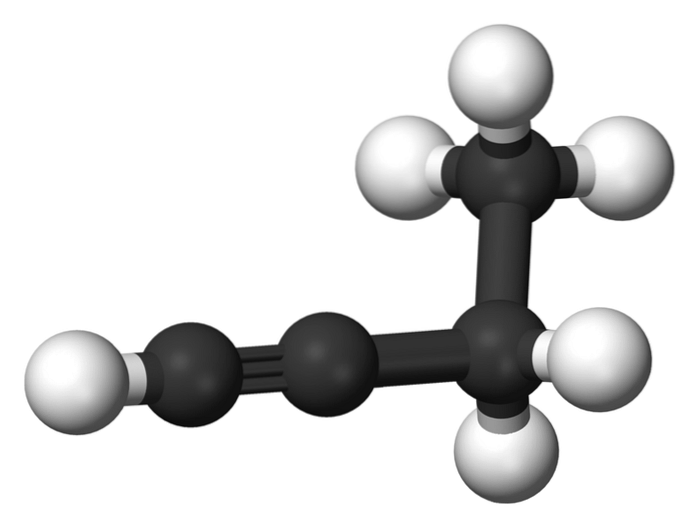
Denne stive og sterkere bindingen enn en enkelt- eller dobbeltbinding mellom karbonatomer gir en stabil konfigurasjon av lineær geometri til 1-butyne..
På den annen side er dette gassformige stoffet ganske brannfarlig, så i nærvær av varme kan det lett forårsake brann eller eksplosjoner og har stor reaktivitet i nærvær av luft eller vann..
2-butyne
Da indre alkyner har større stabilitet enn terminale alkyner, tillater de transformasjon av 1-butyn til 2-butyn.
Denne isomeriseringen kan skje ved oppvarming av 1-butyn i nærvær av en base (som NaOH, KOH, NaOCH3 ...) eller gjennom omlegging av 1-butyne i en løsning av kaliumhydroksid (KOH) i etanol (CtoH6ELLER).
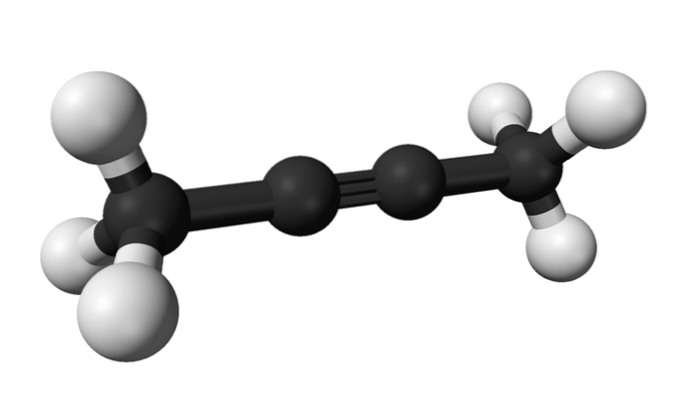
På samme måte kalles det kjemiske stoffet kjent som 2-butyne også dimetylacetylen (eller krotonylen), og presenterer seg selv som en flytende og flyktig art som har kunstig opprinnelse..
I 2-butyne er trippelbindingen funnet i midten av molekylet, noe som gir den større stabilitet enn dens isomer.
I tillegg har denne fargeløse forbindelsen en lavere tetthet enn vann, selv om den anses som uoppløselig i den og har høy antennbarhet..
Eiendommer
-Strukturformelen til butyne (uansett hvilken isomer det refereres til) er C4H6, som har en lineær struktur.
-En av de kjemiske reaksjonene som butynmolekylet gjennomgår, er isomerisering, der en omorganisering og migrering av trippelbindingen skjer i molekylet..
-1-butyne er i gassfasen, har svært høy antennelighet og høyere tetthet enn luft.
-Dette stoffet er også ganske reaktivt, og i nærvær av varme kan det forårsake voldsomme eksplosjoner..
-I tillegg, når denne fargeløse gassen gjennomgår en ufullstendig forbrenningsreaksjon, kan den forårsake karbonmonoksid (CO).
-Når begge isomerer utsettes for høye temperaturer, kan de gjennomgå eksplosive polymeriseringsreaksjoner..
-2-Butyne er i væskefasen, selv om det også regnes som ganske brannfarlig under standard forhold for trykk og temperatur..
-Disse stoffene kan gjennomgå voldsomme reaksjoner når de er i nærvær av sterke oksiderende stoffer..
-På samme måte, når de er i nærvær av reduserende arter, oppstår eksoterme reaksjoner med en påfølgende frigjøring av hydrogengass..
-Ved kontakt med visse katalysatorer (for eksempel noen sure stoffer) eller initierende arter, kan eksoterme polymerisasjonsreaksjoner oppstå.
applikasjoner
Fordi de har noen forskjellige egenskaper, kan begge isomerer ha forskjellige bruksområder og applikasjoner, som vist nedenfor:
For det første er ofte en av anvendelsene av 1-butyne bruken som et mellomtrinn i produksjonsprosessen av andre stoffer av organisk natur av syntetisk opprinnelse..
På den annen side brukes denne kjemiske arten i gummiproduksjonsindustrien og avledede forbindelser; som for eksempel når du vil skaffe deg benzol.
På lignende måte brukes den i produksjonsprosessen av et stort utvalg av plastprodukter, så vel som i utarbeidelsen av mange polyetylenstoffer som anses som høy tetthet..
Også 1-butyne brukes ofte som en komponent for skjære- og sveiseprosesser av noen metalllegeringer, inkludert stål (jern-karbonlegering)..
I en annen forstand brukes 2-butyn-isomeren i kombinasjon med en annen alkyn som kalles propyn i syntesen av noen stoffer kjent som alkylerte hydrokinoner, når den totale synteseprosessen av α-tokoferol (vitamin E) utføres..
Referanser
- Wikipedia. (s.f.). Butyne. Gjenopprettet fra en.wikipedia.org
- Yoder, C. H., Leber P. A. og Thomsen, M. W. (2010). Broen til organisk kjemi: begreper og nomenklatur. Gjenopprettet fra books.google.co.ve
- Study.com. (s.f.). Butyne: Structural Formula & Isomers. Hentet fra studien.
- PubChem. (s.f.). 1-Butyne. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov
- PubChem. (s.f.). 2-Butyne. Hentet fra pubchem.ncbi.nlm.nih.gov

Ingen har kommentert denne artikkelen ennå.