
Varmeabsorberte formler, hvordan man beregner det og løste øvelser
De absorbert varme Det er definert som overføring av energi mellom to legemer ved forskjellige temperaturer. Den med lavere temperatur absorberer varmen til den med høyere temperatur. Når dette skjer, øker termisk energi til stoffet som absorberer varme, og partiklene som komponerer det, vibrerer raskere og øker sin kinetiske energi..
Dette kan føre til en økning i temperaturen eller en endring i tilstanden. Gå for eksempel fra fast til væske, for eksempel is når den smelter i kontakt med vann eller brus ved romtemperatur.

Takket være varme er det også mulig for gjenstander å endre dimensjonene. Termisk ekspansjon er et godt eksempel på dette fenomenet. Når de fleste stoffer blir varmet opp, opplever de vanligvis en økning i dimensjonene.
Et unntak fra dette er vann. Den samme mengden flytende vann øker volumet når det avkjøles til under 4 ºC. I tillegg kan temperaturendringer også oppleve endringer i dens tetthet, noe som også er veldig observerbart når det gjelder vann..
Artikkelindeks
- 1 Hva den består av og formler
- 1.1 Kalorier
- 2 Hvordan beregne det?
- 2.1 Energibalansen
- 3 Øvelsen løst
- 3.1 Tilnærming
- 3.2 Data
- 4 Referanser
Hva den består av og formler
Når det gjelder energi under transport, er enhetene av absorbert varme Joule. Men i lang tid hadde varmen sine egne enheter: kalorien.
Selv i dag brukes denne enheten til å kvantifisere energiinnholdet i maten, selv om en diettkalori tilsvarer en kilokalori varme.
Kalorier
Kalorien, forkortet som kalk, er den mengden varme som trengs for å øke temperaturen på 1 gram vann med 1 ºC.
På 1800-tallet gjennomførte Sir James Prescott Joule (1818 - 1889) et kjent eksperiment der han klarte å transformere mekanisk arbeid til varme, og oppnådde følgende ekvivalens:
1 kalori = 4,166 Joule
I britiske enheter kalles varmeenheten Btu (Britisk termisk enhet), som er definert som mengden varme som trengs for å øke temperaturen på et kilo vann med 1ºF.
Ekvivalensen mellom enhetene er som følger:
1 Btu = 252 kalorier
Problemet med disse eldre enhetene er at varmemengden avhenger av temperaturen. Det vil si at den som kreves for å gå fra 70 ° C til 75 ° C, ikke er den samme som for eksempel å varme opp vannet fra 9 ° C til 10 ° C..
Det er derfor definisjonen vurderer veldefinerte områder: fra 14,5 til 15,5 ° C og 63 til 64 ° F for henholdsvis kalori og Btu..
På hva avhenger mengden absorbert varme?
Mengden opptatt varme som et materiale tar opp, avhenger av flere faktorer:
- Masse. Jo større masse, jo mer varme er den i stand til å absorbere.
- Stoffets kjennetegn. Det er stoffer som, avhengig av molekylær eller atomstruktur, er i stand til å absorbere mer varme enn andre..
- Temperatur. Tilsetning av mer varme er nødvendig for å oppnå en høyere temperatur.
Mengden varme, betegnet som Spørsmål, den er proporsjonal med faktorene som er beskrevet. Derfor kan det skrives som:
Q = m.c.ΔT
Hvor m er massen til objektet, c er en konstant samtale spesifikk varme, en iboende egenskap av stoffet og ΔT er temperaturvariasjonen som oppnås ved å absorbere varme.
AT = TF - Teller
Denne forskjellen har et positivt tegn, da det forventes at når det absorberer varme TF > Teller. Dette skjer med mindre stoffet gjennomgår en faseendring, for eksempel vann som går fra væske til damp. Når vann koker, forblir temperaturen konstant på omtrent 100 ° C, uansett hvor raskt det koker..
Hvordan beregne det?
Ved å sette to gjenstander ved forskjellige temperaturer i kontakt etter en stund når de begge termisk likevekt. Da utjevner temperaturene seg og varmeoverføringen opphører. Det samme skjer hvis mer enn to gjenstander kommer i kontakt. Etter en viss tid vil de alle ha samme temperatur.
Forutsatt at gjenstandene i kontakt danner et lukket system, hvorfra varme ikke kan unnslippe, gjelder prinsippet om bevaring av energi, så det kan sies at:
Spørsmål absorbert = - Q ga etter
Dette representerer en energibalanse, lik den som en persons inntekt og utgifter. Av denne grunn har den overførte varmen et negativt tegn, siden den endelige temperaturen for objektet som gir, er lavere enn den opprinnelige. Derfor:
AT = TF - Teller < 0
Q-ligningen absorbert = - Q ga etter den brukes når to gjenstander er i kontakt.
Energibalanse
For å utføre energibalansen er det nødvendig å skille gjenstandene som absorberer varme fra de som gir, og deretter:
Σ Spørsmålk= 0
Summen av energigevinster og tap i et lukket system må være lik 0.
Den spesifikke varmen til et stoff
For å beregne mengden absorbert varme er det nødvendig å vite den spesifikke varmen til hvert deltakende stoff. Dette er den mengden varme som kreves for å øke temperaturen på 1 g materiale med 1ºC. Enhetene i det internasjonale systemet er: Joule / kg. K.
Det er tabeller med den spesifikke varmen til mange stoffer, vanligvis beregnet ved hjelp av et kalorimeter eller lignende verktøy..
Et eksempel på hvordan man beregner den spesifikke varmen til et materiale
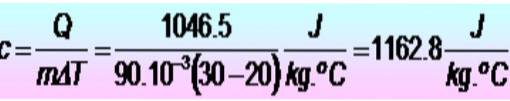
250 kalorier kreves for å øke temperaturen på en metallring fra 20 til 30 ºC. Hvis ringen har en masse på 90 g. Hva er metallets spesifikke varme i SI-enheter??
Løsning
Enheter konverteres først:
Q = 250 kalorier = 1046,5 J
m = 90 g = 90 x 10-3 kg
Treningen løst
En aluminiumskopp inneholder 225 g vann og en 40 g kobberomrører, alt ved 27 ° C. En 400 g sølvprøve ved en innledende temperatur på 87 ° C plasseres i vannet.
Omrøreren brukes til å røre blandingen til den når sin endelige likevektstemperatur på 32 ° C. Beregn massen på aluminiumskoppen, med tanke på at det ikke er varmetap for miljøet.
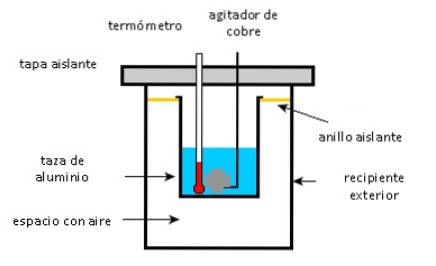
Nærme seg
Som nevnt ovenfor er det viktig å skille mellom gjenstander som gir opp varme fra de som absorberer:
- Aluminiumsbeger, kobberrører og vann absorberer varme.
- Sølvprøve gir varme.
Data
Den spesifikke varmen til hvert stoff leveres:
- Sølv: c = 234 J / kg. ºC
- Kobber: c = 387 J / kg. ºC
- Aluminium c = 900 J / kg. ºC
- Vann c = 4186 J / kg. ºC
Varmen absorbert eller overført av hvert stoff beregnes ved hjelp av ligningen:
Q = m.c.λT
Løsning
Sølv
Spørsmål ga etter = 400 x 10 -3 . 234 x (32 - 87) J = -5148 J
Kobberomrører
Spørsmål absorbert = 40 x 10 -3 . 387 x (32 - 27) J = 77,4 J
Vann
Spørsmål absorbert = 225 x 10 -3 . 4186 x (32 - 27) J = 4709,25 J
Aluminium krus
Spørsmål absorbert = m aluminium . 900 x (32 - 27) J = 4500 .m aluminium
Bruker:
Σ Spørsmålk= 0
77,4 + 4709,25 + 4500 .m aluminium = - (-5148)
Endelig er massen av aluminium ryddet:
m aluminium = 0,0803 kg = 80,3 g
Referanser
- Giancoli, D. 2006. Fysikk: prinsipper med applikasjoner. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fysikk: En titt på verden. 6ta Forkortet utgave. Cengage læring. 156 - 164.
- Rex, A. 2011. Fundamentals of Physics. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Universitetsfysikk med moderne fysikk. 14th. Volum1. 556 - 553.
- Serway, R., Vulle, C. 2011. Fundamentals of Physics. 9na Cengage læring. 362 - 374



Ingen har kommentert denne artikkelen ennå.