
Latent varme

Hva er latent varme?
Latent varme er den mengden varme som et stoff trenger for å absorbere eller frigjøre for å endre sin fysiske tilstand eller fase, og holder temperaturen konstant under denne prosessen. Varmen som tilføres eller frigjøres manifesterer seg ikke, den "føles" ikke som vanlig i en temperaturvariasjon; derav begrepet latent varme.
Det latente ordet kommer fra det latinske ordet "latens" som betyr skjult, så latent varme oppfører seg som om det ikke eksisterte da temperaturen ble holdt konstant. Men det eksisterer: det som skjer er at det blir fullstendig konsumert i faseendring eller fysisk tilstand.
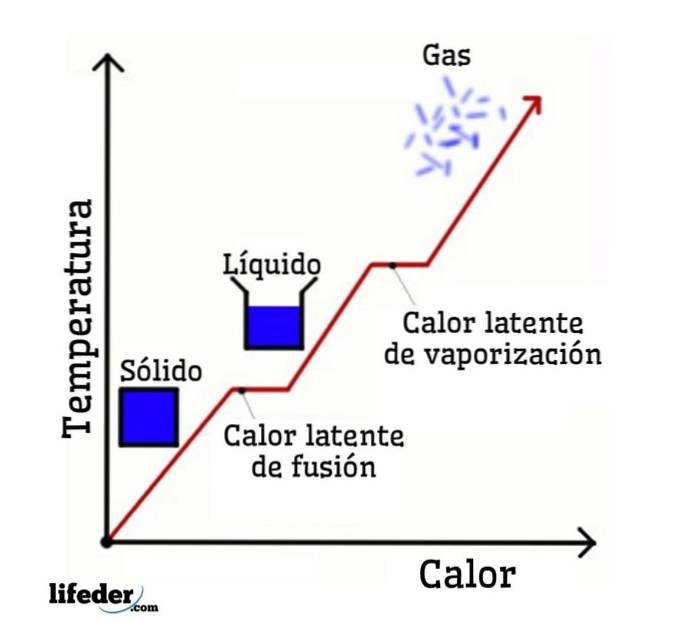
Tar vi vann som et eksempel, er faseendringene som følger: is (fast stoff) smelter i flytende vann (væske) i en prosess som kalles smelting; og flytende vann fordamper igjen og omdannes til vanndamp (gass) i en prosess som kalles fordampning.
På den annen side avkjøles vanndamp til flytende vann i en prosess som kalles kondens; og flytende vann blir tilbake til is i en prosess som kalles størkning.
Hver av disse faseendringene er assosiert med en latent varme, som kan være positiv (absorpsjon) eller negativ (frigjøring)..
Latent fusjonsvarme

Det er mengden varme som må tilføres til en gitt mengde fast stoff for å endre dens fysiske tilstand fra fast til væske. Under fusjon er det ingen temperaturendring, så mens det faste stoffet smelter eller smelter, har væsken som genereres fra det samme temperatur som hele det faste stoffet.
Generelt bestemmes denne varmen ved det normale smeltepunktet, som er temperaturen der det faste stoffet begynner å smelte under atmosfæretrykk. Ved denne temperaturen er det en likevekt eller samtidig tilstedeværelse av fast tilstand og flytende tilstand samtidig..
Den faste tilstanden er preget av tilstedeværelsen av en kompakt struktur på grunn av eksistensen av høyenergiske kjemiske bindinger, som gir den strukturell stivhet. For transformasjon av et fast stoff til væske, må disse interaksjonene brytes, slik at energi forbrukes (absorberes) for det formålet.
Et typisk eksempel er når det forbrukes en is, bestående av vann, sukker og andre stoffer. Det er vanlig å observere at iskrem, hvis den ikke konsumeres raskt, begynner å smelte, det vil si å smelte. Dette skjer når temperaturen på isen når isens smeltepunkt..
Eksempler
Noen eksempler på latente fusjonsvarmer uttrykt i J / g vil bli listet opp; det vil si energien som et gram fast stoff må absorbere for å smelte ved smeltepunktet:
-Ice 334.0
-Aluminium 380.0
-Svovel 38.1
-Kobber 134.0
-Etanol 104,0
-Kvikksølv 11.8
-Gull 64,5
-Sølv 80.3
-Bly 24.5
-Wolfram 184
Is absorberer mye varme ikke fordi samspillet er sterkere, men fordi det er i stand til å spre varme mellom krystallene..
Latent fordampningsvarme
Det er mengden varme som en gitt mengde stoff absorberer for å skifte fra flytende tilstand til gassform ved det normale kokepunktet. Det vil si at det er varmen væsken tar opp når den koker og blir til gass uten temperaturøkning..
Innen væsken kan molekylene til stoffene samhandle ved dannelse av hydrogenbindinger og ved tiltrekningskrefter mellom molekylene. For å overføre et stoff fra flytende tilstand til gassform, må disse kreftene overvinnes, så varme må tilføres.
Sensibel varme er det væsken absorberer bare for å øke temperaturen, som vil avhenge av dens spesifikke varme. I mellomtiden blir den latente fordampningsvarmen brukt til å transformere den direkte til damp, en prosess som er mye lettere ved kokepunktet..
Eksempler
Nedenfor er eksempler på noen væsker med deres respektive latente fordampningsvarme uttrykt i J / g:
-Eddiksyre 402
-Aceton 518
-Vann 2256
-Etylalkohol 846
-Svovel 1510
-Benzen 390
-Karbondioksid 574
-Klor 293
-Ether 377
-Glyserin 974
-Kvikksølv 295
-Oksygen 214
Legg merke til den enorme latente varmen av flytende vann: 1 g flytende vann (ca. 1 ml) trenger å absorbere 2256 J for å fordampe. Flytende vann sprer varmen det mottar enda bedre sammenlignet med is.
Latent størkningsvarme
Det er varmen en viss mengde stoff må avgi for å gå fra den flytende tilstanden til den faste tilstanden ved størkning eller frysing. Igjen, til væsken har størknet helt, vil temperaturen forbli konstant..
Stivningsprosessen er det motsatte av fusjonsprosessen, så verdiene for den latente stivningsvarmen og de for den latente fusjonsvarmen er de samme, men med motsatte tegn..
Molekylene til et stoff i flytende tilstand beveger seg med en viss frihet på grunn av energien de har. Derfor, for å passere til den faste fasen, må molekylene frigjøre energi i form av varme, som tillater større interaksjon mellom stoffets molekyler..
Samspillet mellom molekylene favoriserer dannelsen av de kjemiske bindingene i den faste fasen. Et eksempel på dette skjer når flytende vann plasseres i de isdannende beholderne i kjøleskapet. Fryseren trekker ut varme fra det flytende vannet og størkner for å bli is.
Eksempler
Noen eksempler på latente stivningsvarme (i J / g) for noen væsker er listet opp nedenfor:
-Vann (-334)
-Aluminium (-380)
-Svovel (-38)
-Kobber (-134)
-Etanol (-104)
Latent kondensvarme
Det er mengden varme som må avgis eller frigjøres fra en viss mengde stoff for å gå fra gasstilstand til flytende tilstand. Gassen som kondenserer og væsken som dannes opprettholder den samme temperaturen under kondens.
Kondens er det motsatte av fordampning. Den latente kondensvarmen har samme verdi som den latente fordampningsvarmen, men med motsatt tegn, og ved kokepunktet. Et eksempel på dette er når matlaging og damp kondenserer på innsiden av pottene..
Gassformige molekyler beveger seg fritt drevet av energien de har. Derfor må de frigjøre energi for å tillate intermolekylære interaksjoner av flytende tilstand å etablere seg mellom stoffets molekyler..
I naturen er det mange andre eksempler på fenomenet vannkondens. Vanndamp stiger opp i atmosfæren og kondenserer i skyene i form av vanndråper.
Tilstedeværelsen av vanndråper i bilvinduene observeres også som et resultat av kondensering av vann på grunn av et temperaturfall som oppstår tidlig om morgenen, og utgjør den såkalte dugg.
Eksempler
Til slutt, for noen damper, blir deres respektive latente kondensvarme uttrykt, igjen, i J / g oppført:
-Eddiksyre (-402)
-Aceton (-518)
-Vann (-2256)
-Etylalkohol (-846)
-Svovel (-1510)
-Benzen (-390)
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Walter J. Moore. (1963). Fysisk kjemi. I kjemisk kinetikk. Fjerde utgave, Longmans.
- Wikipedia. (2020). Latent varme. Gjenopprettet fra: en.wikipedia.org
- Redaksjonen av Encyclopaedia Britannica. (2020). Latent varme. Gjenopprettet fra: britannica.com
- Engineering ToolBox. (2003). Væsker: Latent fordampningsvarme. Gjenopprettet fra: engineeringtoolbox.com
- Lumenlæring. (s.f.). Faseendring og latent varme. Gjenopprettet fra: courses.lumenlearning.com



Ingen har kommentert denne artikkelen ennå.