
Aluminiumkarbonatstruktur, egenskaper, bruksområder

De aluminiumkarbonat er et uorganisk salt med kjemisk formel Alto(CO3)3. Det er et praktisk talt ikke-eksisterende metallisk karbonat, gitt sin høye ustabilitet under normale forhold..
Blant årsakene til ustabiliteten kan vi nevne de svake elektrostatiske interaksjonene mellom Al-ioner3+ og CO3to-, som i teorien burde være veldig sterke på grunn av størrelsen på ladningene.
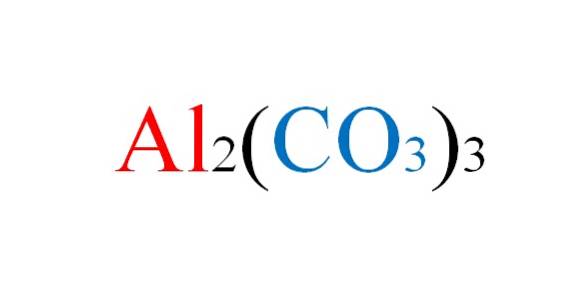
Salt har ingen ulemper på papir når de kjemiske ligningene av dets reaksjoner skrives; men i praksis snur det mot ham.
Til tross for det som er blitt sagt, kan aluminiumkarbonat forekomme i selskap med andre ioner, slik det skjer med mineralet dawsonite. Det er også et derivat der det samhandler med vandig ammoniakk. For resten regnes det som en blanding mellom Al (OH)3 og HtoCO3; som er lik en brusende oppløsning med et hvitt bunnfall.
Denne blandingen har medisinsk bruk. Imidlertid til det rene, isolerbare og manipulerbare saltet til Alto(CO3)3, ingen kjente mulige applikasjoner; i det minste ikke under enormt press eller ekstreme forhold.
Artikkelindeks
- 1 Struktur av aluminiumkarbonat
- 1.1 Aluminiumammoniumhydroksydkarbonat
- 2 eiendommer
- 2.1 Molare masse
- 2.2 Ustabilitet
- 2.3 Fysisk
- 3 bruksområder
- 4 Referanser
Struktur av aluminiumkarbonat
Krystallstrukturen for dette saltet er ukjent, fordi den er så ustabil at den ikke kunne karakteriseres. Fra formelen Alto(CO3)3, Imidlertid er det kjent at andelen Al-ioner3+ og CO3to- er 2: 3; det vil si for hvert annet Al-kationto+ det må være tre CO-anioner3to- samhandler elektrostatisk med dem.
Problemet er at begge ionene er veldig forskjellige i størrelse; Al3+ er veldig liten mens CO3to- det er klumpete. Denne forskjellen i seg selv påvirker allerede gitterstabiliteten til krystallgitteret, hvis ioner vil samhandle "vanskelig" hvis dette saltet kunne isoleres i fast tilstand.
I tillegg til dette aspektet har Al3+ det er et høyt polariserende kation, en egenskap som deformerer den elektroniske skyen av CO3to-. Det er som om du vil tvinge den til å binde kovalent, selv om anionet ikke kan det..
Følgelig ioniske interaksjoner mellom Al3+ og CO3to- de har en tendens til kovalens; en annen faktor som legger til ustabiliteten til Alto(CO3)3.
Aluminium ammoniumhydroksydkarbonat
Det kaotiske forholdet mellom Al3+ og CO3to- mykner i utseende når andre ioner er tilstede i glasset; slik som NH4+ og OH-, fra en løsning av ammoniakk. Denne kvartetten av ioner, Al3+, CO3to-, NH4+ og OH-, de klarer å definere stabile krystaller, til og med i stand til å ta i bruk forskjellige morfologier.
Et annet eksempel som ligner på dette, observeres i mineralet dawsonite og dets ortorombiske krystaller, NaAlCO3(ÅH)to, der Na+ erstatter NH4+. I disse saltene er deres ioniske bindinger sterke nok til at vannet ikke fremmer frigjøring av CO.to; eller i det minste ikke brått.
Selv om NH4Al (OH)toCO3 (AACC, for forkortelsen på engelsk), og heller ikke NaAlCO3(ÅH)to representerer aluminiumkarbonat, kan de betraktes som basiske derivater derav.
Eiendommer
Molarmasse
233,98 g / mol.
Ustabilitet
I forrige avsnitt ble det forklart fra et molekylært perspektiv hvorfor Alto(CO3)3 det er ustabilt. Men hvilken transformasjon gjennomgår den? Det er to situasjoner å vurdere: den ene tørr og den andre "våt".
Tørke
I tørr situasjon anionen CO3to- går tilbake til COto ved følgende nedbrytning:
Tilto(CO3)3 => AltoELLER3 + 3COto
Noe som er fornuftig hvis det syntetiseres under høyt CO-trykk.to; det vil si omvendt reaksjon:
TiltoELLER3 + 3COto => Alto(CO3)3
Derfor, for å forhindre Alto(CO3)3 saltet skal utsettes for høyt trykk (ved bruk av Nto, for eksempel). På denne måten dannes COto ville ikke være termodynamisk favorisert.
Våt
Mens i våt situasjon, CO3to- gjennomgår hydrolyse, som genererer små mengder OH-; men nok til å utfelle aluminiumhydroksydet, Al (OH)3:
CO3to- + HtoELLER <=> HCO3- + Åh-
Til3+ + 3OH- <=> Al (OH)3
Og på den annen side, Al3+ hydrolyserer også:
Til3+ + HtoELLER <=> Al (OH)toto+ + H+
Selv om Al faktisk ville hydrere først3+ for å danne komplekset Al (HtoELLER)63+, som hydrolyseres for å gi [Al (HtoELLER)5ÅH]to+ og H3ELLER+. Så ble H3O (eller H+) proton til CO3to- til HtoCO3, som nedbrytes til COto og HtoELLER:
CO3to- + 2H+ => HtoCO3
HtoCO3 <=> COto + HtoELLER
Merk at til slutt Al3+ oppfører seg som en syre (frigjør H+) og en base (frigjør OH- med løselighetsbalansen til Al (OH)3); det vil si at den viser amfoterisme.
Fysisk
Hvis det kan isoleres, vil dette saltet sannsynligvis være hvitt i fargen, som mange andre aluminiumsalter. Også på grunn av forskjellen mellom de ioniske radiene av Al3+ og CO3to-, det ville sikkert ha veldig lave smelte- eller kokepunkter sammenlignet med andre ioniske forbindelser.
Og når det gjelder løselighet, vil den være uendelig løselig i vann. Videre ville det være et hygroskopisk og lekker stoff. Dette er imidlertid bare gjetning. Andre egenskaper må estimeres med datamodeller som utsettes for høyt trykk..
applikasjoner
De kjente anvendelsene av aluminiumkarbonat er medisinske. Det ble brukt som en mild astringerende og som et medikament for å behandle magesår og betennelse. Det har også blitt brukt for å forhindre dannelse av urinstein hos mennesker..
Det har blitt brukt til å kontrollere en økning i kroppens fosfatinnhold og også til å behandle symptomer på halsbrann, syre fordøyelsesbesvær og magesår..
Referanser
- XueHui L., Zhe T., YongMing C., RuiYu Z. & Chenguang L. (2012). Hydrotermisk syntese av ammoniumaluminiumkarbonathydroksid (AACH) Nanoplatelets and Nanofibers pH-Controlled Morphologies. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Ammoniumaluminiumkarbonathydroksyd NH4Al (OH) 2CO3 som en alternativ rute for aluminiumoksydpreparat: sammenligning med den klassiske boehmittforløperen. Pulverteknologi, 320, 565-573, DOI: 10.1016 / j.powtec.2017.07.0080
- Nasjonalt senter for bioteknologisk informasjon. (2019). Aluminiumkarbonat. PubChem Database., CID = 10353966. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Aluminiumkarbonat. Gjenopprettet fra: en.wikipedia.org
- Aluminiumsulfat. (2019). Aluminiumkarbonat. Gjenopprettet fra: aluminiumsulfate.net



Ingen har kommentert denne artikkelen ennå.