
Litiumkarbonat (Li2CO3) struktur, egenskaper, bruksområder

De litiumkarbonat er et uorganisk fast stoff dannet av to litium Li-kationer+ og et karbonatanion CO3to-. Den kjemiske formelen er LitoCO3. LitoCO3 er et hvitt krystallinsk fast stoff som kan oppnås ved reaksjonen mellom litiumhydroksyd og karbondioksid.
Litiumkarbonat har et veldig høyt smeltepunkt, og det er derfor det brukes til fremstilling av glass, keramikk og porselen. Den har et bredt spekter av bruksområder, for eksempel i oppladbare litiumbatterier, til fremstilling av andre litiumforbindelser, i sveiseelektroder og i maling og lakk..

Li brukes ogsåtoCO3 i sementblandinger for rask herding og aluminiumsproduksjon.
En av de viktigste bruksområdene er i behandlingen av noen psykiske lidelser som depresjon og for aggressiv oppførsel, blant andre forhold..
Imidlertid må bruken som medisin behørig kontrolleres av medisinske spesialister siden personer behandlet med LitoCO3 kan ha skadelige effekter på helsen din, for eksempel hypotyreose (nedsatt funksjon av skjoldbruskkjertelen).
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 Fysiske egenskaper
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Nedbrytning
- 3,5 Tetthet
- 3.6 Løselighet
- 3,7 pH
- 4 Kjemiske egenskaper
- 5 Biologiske egenskaper
- 6 Motta
- 7 bruksområder
- 7.1 Ved behandling av psykiske lidelser
- 7.2 Ved behandling av symptomer på andre sykdommer
- 7.3 Administrasjonsmåte
- 8 Bivirkninger
- 8.1 Tilfeller der det ikke skal administreres
- 9 Andre bruksområder
- 10 Referanser
Struktur
Litiumkarbonat består av to litium Li-kationer+ og et karbonatanion CO3to-.
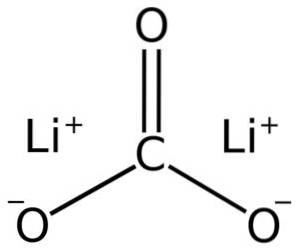
Elektronkonfigurasjonen av litium i oksidasjonstilstand +1 er 1sto 2s0, siden det har mistet elektronet til det siste skallet, og dermed er mer stabilt. Karbonationen CO3to- har en flat struktur.
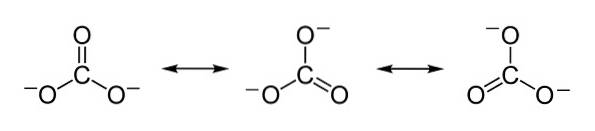
Negative ladninger fordeles likt mellom de tre oksygenatomene i karbonationen CO3to-.
Nomenklatur
-Litiumkarbonat
-Dilithiumkarbonat
Fysiske egenskaper
Fysisk tilstand
Hvitt krystallinsk fast stoff med monoklinisk struktur
Molekylær vekt
73,9 g / mol
Smeltepunkt
723 ºC
Nedbrytning
Den brytes ned ved 1300 ºC.
Tetthet
2,11 g / cm3
Løselighet
Lett løselig i vann: 1,31 vekt% ved 20 ºC. Dens løselighet i vann synker med økende temperatur. Det er løselig i fortynnede syrer. Det er uoppløselig i alkohol og aceton.
pH
Løsninger i vann er alkaliske, har en pH større enn 7.
Kjemiske egenskaper
LitoCO3 hydrolyserer i vandig løsning og genererer en grunnleggende løsning. Den lille andelen av forbindelsen som er solubilisert i vann, etterlater karbonatanionen CO fri.3to-.
Karbonatanionen CO3to- fri i vandig oppløsning tar en proton for å danne bikarbonatanionet HCO3-, som det kan sees i følgende reaksjon:
CO3to- + HtoO → HCO3- + Åh-
Tilstedeværelsen av OH-ioner- er det som gjør løsningen grunnleggende.
Biologiske egenskaper
Spor av litiumion er normalt tilstede i dyre- og humane vev, men ingen naturlige fysiologiske rolle for dette ionet er så langt kjent..
I den menneskelige organismen har LitoCO3 inntatt som et medikament, virker det på en rekke signalmekanismer i nevroner og andre celler. Dette er resultatet av erstatning av kationer som natrium og kalium.
Inkorporering av litiumion i strukturen til cellemembranen kan endre responsen på hormoner og koblingen av cellen med energiprosesser.
På denne måten modifiserer litium flere cellulære prosesser inkludert metabolisme..
Gjennom å endre måten celler fungerer på, LitoCO3 kan handle på kommunikasjonsmekanismene til nevroner i hjernen.
Å skaffe
LitoCO3 kan oppnås ved omsetning av litiumhydroksyd LiOH med karbondioksid COto, som vist under:
2 LiOH + COto → LitoCO3 + HtoELLER
Den er kommersielt produsert av litiumholdige mineraler som spodumen og lepidolit. Disse mineralene behandles ved høye temperaturer med visse sulfatsalter eller med alkaliske forbindelser for å oppnå litiumsalter..
De oppnådde litiumsaltene renses med vann eller syreoppløsninger og behandles deretter med karbonater for å danne LitoCO3.
Imidlertid LitoCO3 Oppnådd på denne måten er den forurenset med sulfater eller klorider av kalsium, magnesium, jern, natrium, kalium, etc. så det krever ytterligere rensing.
applikasjoner
Ved behandling av psykiske lidelser
Det brukes som et antidepressivt, antimanisk middel, i behandlingen av aggressiv-impulsiv atferd og for bipolare lidelser (mennesker som plutselig forandrer humør uten grunn, blir voldelige).

Leger har observert at administreringen fører til en reduksjon i intensiteten og hyppigheten av alvorlige perioder med depresjon og maniske episoder..
Den brukes alene, det vil si uten tilsatt forbindelse, i vedlikeholdsbehandling av unipolar depresjon og for schizoaffektiv lidelse. Det tjener også til å øke den antidepressive effekten av andre medisiner.
Selv om det har blitt brukt til å behandle barn med tilsynelatende symptomer på bipolar lidelse og hyperaktivitet med nevrotiske eller aggressive komponenter, har det ikke vært effektivt i alle tilfeller..
Ved behandling av symptomer på andre sykdommer
Det brukes til å redusere frekvensen av alvorlig, tilbakevendende og kronisk hodepine.
Det brukes til å redusere forekomsten av infeksjon hos pasienter med nøytropeni indusert av cellegift eller av andre grunner. Nøytropeni er en reduksjon i nøytrofiler, en type hvite blodlegemer som hjelper til med å bekjempe infeksjoner i kroppen.
Det har blitt brukt som en skjoldbruskenzyminhibitor for behandling av hypertyreose, men det er ikke den foretrukne behandlingen på grunn av dets bivirkninger.
Administrasjonsform
Den brukes i form av tabletter eller kapsler av LitoCO3. Også i tabletter med langsom frigjøring med litiumcitrat. Li foretrekkestoCO3 fordi det ikke irriterer halsen ved svelging, slik tilfellet er med andre litiumsalter.

Bivirkninger
LitoCO3 kan ha en skadelig effekt på skjoldbruskkjertelen og nyrene, så funksjonen til disse organene bør overvåkes før og under behandling med denne forbindelsen..
LitoCO3 det kan være giftig i konsentrasjoner veldig nær de som brukes i medisinske behandlinger, så det kreves en kontinuerlig gjennomgang av verdiene i blodserum.
Symptomer på Li-forgiftningtoCO3 er skjelving, muskelspasmer, muskelsvakhet, diaré, oppkast, døsighet eller ataksi (nedsatt muskelkoordinasjon), blant andre.
Når du starter behandling med LitoCO3 Symptomer som skjelving, hodepine og kvalme kan også forekomme. Men disse har en tendens til å forsvinne når medisinen fortsetter..
De fleste behandlede kan også utvikle leukocytose (en økning i antall hvite blodlegemer), men dette er reversibelt..
Folk som blir medisinert med LitoCO3 de skal ikke kjøre bil eller bruke maskiner, fordi fysisk koordinering og evnen til å utføre aktiviteter som krever årvåkenhet reduseres.
Tilfeller der det ikke skal administreres
Det skal ikke brukes til barn under 12 år, da det kan forstyrre dannelsen av bein og dens tetthet, siden det endrer konsentrasjonene av et skjoldbruskhormon. Det har også en tendens til å ta plassen til kalsium i beinene..
De skal ikke behandles med LitoCO3 personer med kardiovaskulær sykdom, nyre eller skjoldbruskkjertel. Verken hos alvorlig dehydrerte pasienter.
Det bør ikke gis til gravide kvinner, spesielt i første trimester av svangerskapet. Litium krysser morkaken og kan lett nå fosteret med mulige teratogene effekter, det vil si at det kan forårsake abnormiteter eller misdannelser hos det ufødte barnet..
Eldre som trenger behandling med LitoCO3 bør behandles med forsiktighet og med lavere doser enn hos unge voksne, da de kan utvikle hypothyroid sykdom.
Andre bruksområder
LitoCO3 høy renhet er mye brukt i produksjonen av oppladbare litiumbatterier.
Brukes i smeltede karbonatbrenselceller.
Den brukes til fremstilling av elektrisk porselen, som er en type elektrisk isolerende porselen. Det brukes også til produksjon av glasur på keramikk.

Det tillater fremstilling av keramikk med lav ekspansjonskoeffisient, det vil si at den utvides veldig lite med økende temperatur, slik at keramikken kan brukes i et høyere temperaturområde.
Andre bruksområder er som katalysator, ved fremstilling av andre litiumforbindelser, som belegg for sveising av elektroder, i selvlysende malingsformler, lakker og fargestoffer, samt i elektrolytisk produksjon av aluminium..
Det er nyttig å generere en raskere innstilling av sementen og tilsettes limet på flisene slik at de kan fikses på kort tid.

Referanser
- Cai, W. et al. (2018). Fjerning av SO4to- fra LitoCO3 ved omkrystallisering i NatoCO3. Crystals 2018, 8, 19. Gjenopprettet fra mdpi.com.
- Gadikota, G. (2017). Koble de morfologiske og krystallstrukturelle endringene under konvertering av litiumhydroksydmonohydrat til litiumkarbonat ved hjelp av målinger for røntgenstrålespredning i flere skala. Mineraler 2017, 7, 169. Gjenopprettet fra mdpi.com.
- OSS. National Library of Medicine. (2019). Litiumkarbonat. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Fjerde utgave. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte utgave. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.


Ingen har kommentert denne artikkelen ennå.