
Hydrobromsyre (HBr) struktur, egenskaper, dannelse

De hydrobromsyre Det er en uorganisk forbindelse som skyldes vandig oppløsning av en gass som kalles hydrogenbromid. Den kjemiske formelen er HBr, og den kan betraktes på forskjellige ekvivalente måter: som et molekylhydrid, eller et hydrogenhalogenid i vann; det vil si et hydracid.
I kjemiske ligninger skal det skrives som HBr (ac), og indikerer dermed at det er hydrobromsyren og ikke gassen. Denne syren er en av de sterkeste kjente, enda mer enn saltsyre, HCl. Forklaringen på dette ligger i naturen til dens kovalente binding.
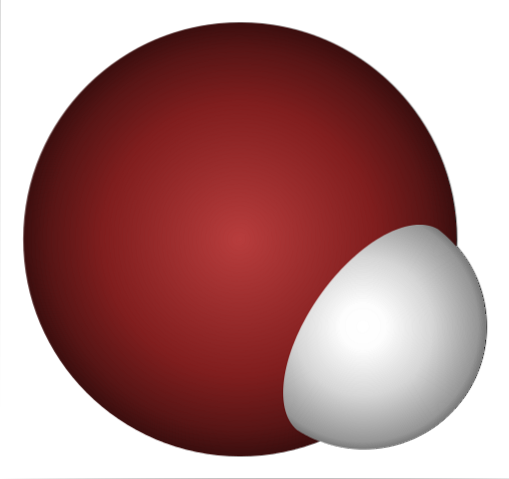
Hvorfor er HBr så sterk syre, og enda mer oppløst i vann? Fordi H-Br kovalent binding er veldig svak, på grunn av dårlig overlapping av 1s orbitaler av H og 4p av Br.
Dette er ikke overraskende hvis du ser nøye på bildet over, der bromatomet (brunt) tydelig er mye større enn hydrogenatomet (hvitt).
Følgelig forårsaker enhver forstyrrelse at H-Br-bindingen brytes og frigjør H-ionet+. Så hydrobromsyre er en Brönsted-syre, siden den overfører protoner eller hydrogenioner. Styrken er slik at den brukes i syntesen av forskjellige organobrominerte forbindelser (slik som 1-bromoetan, CH3CHtoBr).
Hydrobromsyre er, etter hydroiodic, HI, en av de sterkeste og mest nyttige hydracids for fordøyelse av visse faste prøver.
Artikkelindeks
- 1 Struktur av hydrobromsyre
- 1.1 Surhet
- 2 Fysiske og kjemiske egenskaper
- 2.1 Molekylformel
- 2.2 Molekylvekt
- 2.3 Fysisk utseende
- 2.4 Lukt
- 2,5 Luktterskel
- 2.6 Tetthet
- 2.7 Smeltepunkt
- 2.8 Kokepunkt
- 2.9 Løselighet i vann
- 2.10 Damptetthet
- 2.11 Surhet pKa
- 2.12 Kalorikapasitet
- 2.13 Standard molar entalpi
- 2.14 Standard molar entropi
- 2.15 Flammepunkt
- 3 Nomenklatur
- 4 Hvordan dannes det?
- 4.1 Blanding av hydrogen og brom i vann
- 4.2 Fosfor tribromid
- 4.3 Svoveldioksid og brom
- 5 bruksområder
- 5.1 Tilberedning av bromider
- 5.2 Syntese av alkylhalogenider
- 5.3 Katalysator
- 6 Referanser
Struktur av hydrobromsyre
Bildet viser strukturen til H-Br, hvis egenskaper og egenskaper, selv om de er av gass, er nært knyttet til dens vandige løsninger. Det er derfor det kommer et punkt der det er forvirring angående hvilken av de to forbindelsene det refereres til: HBr eller HBr (ac).
Strukturen til HBr (ac) er forskjellig fra HBr, siden vannmolekylene nå løser dette diatomiske molekylet. Når den er nær nok, overføres H+ til et molekyl av HtoEller som angitt i følgende kjemiske ligning:
HBr + HtoO => Br-- + H3ELLER+
Dermed består strukturen av hydrobromsyre av Br-ioner-- og H3ELLER+ samhandler elektrostatisk. Nå er det litt annerledes enn den kovalente bindingen til H-Br.
Den høye surheten skyldes den voluminøse Br-anionen- kan knapt samhandle med H3ELLER+, ikke i stand til å hindre deg i å overføre H+ til en annen omkringliggende kjemisk art.
Surhet
For eksempel, Cl- og F- selv om de ikke danner kovalente bindinger med H3ELLER+, de kan samhandle gjennom andre intermolekylære krefter, for eksempel hydrogenbindinger (som bare F- er i stand til å akseptere dem). Hydrogenbindinger F--H-OHto+ "Hinder" donasjonen av H+.
Det er av denne grunn at flussyre, HF, er en svakere syre. i vann enn hydrobromsyre; siden, de ioniske interaksjonene Br- H3ELLER+ ikke bry deg om overføringen av H+.
Imidlertid, selv om det er vann i HBr (aq), er dets oppførsel til slutt lik den for et H-Br-molekyl; det vil si en H+ overføres fra HBr eller Br-H3ELLER+.
Fysiske og kjemiske egenskaper
Molekylær formel
HBr.
Molekylær vekt
80,972 g / mol. Vær oppmerksom på at, som nevnt i forrige avsnitt, bare HBr blir vurdert og ikke vannmolekylet. Hvis molekylvekten ble tatt fra formelen Br-H3ELLER+ ville ha en verdi på omtrent 99 g / mol.
Fysisk utseende
Fargeløs eller lysegul væske, som vil avhenge av konsentrasjonen av oppløst HBr. Jo mer gul det er, jo mer konsentrert og farlig blir det.
Lukt
Skarp, irriterende.
Luktterskel
6,67 mg / m3.
Tetthet
1,49 g / cm3 (48% vekt / vekt vandig løsning). Denne verdien, så vel som de som tilsvarer smelte- og kokepunktene, avhenger av mengden HBr oppløst i vannet..
Smeltepunkt
-11 ° C (12 ° F, 393 ° K) (49% w / w vandig løsning).
Kokepunkt
122 ºC (252 ºF. 393 ºK) ved 700 mmHg (vandig løsning 47-49% vekt / vekt).
Vannløselighet
-221 g / 100 ml (ved 0 ° C).
-204 g / 100 ml (15 ºC).
-130 g / 100 ml (100 ºC).
Disse verdiene refererer til gassformet HBr, ikke til hydrobromsyre. Som man kan se, når temperaturen øker, avtar oppløseligheten til HBr; atferd som er naturlig i gasser. Derfor, hvis det kreves konsentrerte HBr (aq) -løsninger, er det bedre å jobbe med dem ved lave temperaturer..
Hvis det arbeides ved høye temperaturer, vil HBr rømme i form av gassformede kiselgurmolekyler, så reaktoren må forsegles for å forhindre lekkasje..
Damptetthet
2,71 (i forhold til luft = 1).
Surhet pKa
-9.0. Denne negative konstanten er en indikasjon på dens store surhetsstyrke..
Kalorikapasitet
29,1 kJ / mol.
Standard molar entalpi
198,7 kJ / mol (298 ºK).
Standard molar entropi
-36,3 kJ / mol.
antennelsespunkt
Ikke brannfarlig.
Nomenklatur
Navnet 'hydrobromsyre' kombinerer to fakta: tilstedeværelsen av vann, og at brom har en valens på -1 i forbindelsen. På engelsk er det noe mer opplagt: hydrobromsyre, hvor prefikset 'hydro' (eller hydro) refererer til vann; selv om det faktisk også kan referere til hydrogen.
Brom har en valens på -1 fordi den er bundet til et hydrogenatom mindre elektronegativt enn det; men hvis den var bundet eller interagerer med oksygenatomer, kan den ha mange valenser, for eksempel: +2, +3, +5 og +7. Med H kan den bare vedta en enkelt valens, og det er derfor suffikset -ico blir lagt til navnet.
Mens HBr (g), hydrogenbromid, er vannfri; det vil si at den ikke har vann. Derfor er den navngitt under andre nomenklaturstandarder, tilsvarende den for hydrogenhalogenider..
Hvordan er det dannet?
Det er flere syntetiske metoder for fremstilling av hydrobromsyre. Noen av dem er:
Blanding av hydrogen og brom i vann
Uten å beskrive de tekniske detaljene, kan denne syren oppnås ved direkte blanding av hydrogen og brom i en reaktor fylt med vann..
Hto + Brto => HBr
På denne måten, når HBr dannes, oppløses den i vannet; dette kan trekke den i destillasjonene, slik at løsninger med forskjellige konsentrasjoner kan ekstraheres. Hydrogen er en gass, og brom er en mørk rødaktig væske.
Fosfor tribromid
I en mer forseggjort prosess blandes sand, hydratisert rød fosfor og brom. Vannfeller plasseres i isbad for å forhindre at HBr rømmer og danner hydrobromsyre i stedet. Reaksjonene er:
2P + 3Brto => 2PBr3
PBr3 + 3HtoO => 3HBr + H3PO3
Svoveldioksid og brom
En annen måte å forberede den på er å reagere brom med svoveldioksid i vann:
Brto + SWto + 2HtoO => 2HBr + HtoSW4
Dette er en redoksreaksjon. BRto det reduserer, får elektroner ved å binde seg med hydrogen; mens SOto oksyderer, mister elektroner når det danner mer kovalente bindinger med andre oksygener, som i svovelsyre.
applikasjoner
Bromidpreparat
Bromidsalter kan fremstilles ved å reagere HBr (aq) med et metallhydroksyd. For eksempel vurderes produksjonen av kalsiumbromid:
Ca (OH)to + 2HBr => CaBrto + HtoELLER
Et annet eksempel er for natriumbromid:
NaOH + HBr => NaBr + HtoELLER
Dermed kan mange av de uorganiske bromidene fremstilles.
Syntese av alkylhalogenider
Og hva med organiske bromider? Dette er organobrominerte forbindelser: RBr eller ArBr.
Alkohol dehydrering
Råmaterialet for å skaffe dem kan være alkoholer. Når de protoneres av surheten til HBr, danner de vann, som er en god forlatende gruppe, og i stedet blir det store Br-atomet innlemmet, som vil bli kovalent bundet med karbon:
ROH + HBr => RBr + HtoELLER
Denne dehydrering utføres ved temperaturer over 100 ° C, med sikte på å lette brudd på R-OH-bindingen.to+.
Tilsetning til alkener og alkyner
HBr-molekylet kan tilsettes fra den vandige løsningen til dobbelt- eller trippelbindingen av et alken eller en alkyn:
RtoC = CRto + HBr => RHC-CRBr
RC≡CR + HBr => RHC = CRBr
Flere produkter kan oppnås, men under enkle forhold dannes produktet primært der brom er bundet til et sekundært, tertiært eller kvartært karbon (Markovnikovs regel).
Disse halogenidene er involvert i syntesen av andre organiske forbindelser, og deres bruksområde er svært omfattende. På samme måte kan noen av dem til og med brukes i syntesen eller utformingen av nye medisiner..
Ether spalting
Fra eterne kan to alkylhalogenider oppnås samtidig, som hver bærer en av de to sidekjedene R eller R 'av den innledende eteren R-O-R'. Noe som ligner på dehydrering av alkoholer skjer, men deres reaksjonsmekanisme er forskjellig.
Reaksjonen kan skisseres med følgende kjemiske ligning:
ROR '+ 2HBr => RBr + R'Br
Og vann slippes også ut.
Katalysator
Dens surhet er slik at den kan brukes som en effektiv syrekatalysator. I stedet for å legge til anionet Br- til molekylstrukturen, gir plass for et annet molekyl å gjøre det.
Referanser
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10th utgave.). Wiley pluss.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Steven A. Hardinger. (2017). Illustrert ordliste for organisk kjemi: Hydrobromsyre. Gjenopprettet fra: chem.ucla.edu
- Wikipedia. (2018). Hydrobromsyre. Gjenopprettet fra: en.wikipedia.org
- PubChem. (2018). Hydrobromsyre. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- National Institute of Safety and Hygiene at Work. (2011). Hydrogenbromid. [PDF]. Gjenopprettet fra: insht.es
- PrepChem. (2016). Fremstilling av hydrobromsyre. Gjenopprettet fra: prepchem.com



Ingen har kommentert denne artikkelen ennå.