
Hydrogencyanid molekylær struktur, egenskaper, bruksområder
De hydrocyansyre eller hydrogencyanid er en organisk forbindelse hvis kjemiske formel er HCN. Det er også kjent som metanonitril eller formonitril og inntil for flere år siden som preussinsyre, selv om dette faktisk er en annen forbindelse.
Hydrocyanic acid er en ekstremt giftig, fargeløs gass som oppnås ved å behandle cyanider med syrer. Denne syren finnes inne i ferskenfrøet, også kjent som fersken..

Ved en omgivelsestemperatur på mindre enn 25 ºC er det en væske og over den temperaturen er det en gass. I begge tilfeller er det ekstremt giftig for mennesker, dyr og til og med de fleste mikroorganismer som ikke er vant til det. Det er et godt løsningsmiddel for ioner. Det er veldig ustabilt da det har en tendens til å polymerisere lett.
Det finnes i planteriket innlemmet i molekylene til noen glykosider, fordi når disse blir hydrolysert av enzymer fra planten, oppnås HCN, glukose og benzaldehyd..
Disse glykosidene er i frøene til visse frukter som fersken, aprikoser, kirsebær, plommer og i bitre mandler, så de bør aldri inntas..
Det finnes også i plante glykosider som noen typer sorghum. Også noen bakterier produserer det under metabolismen. Den brukes hovedsakelig til produksjon av polymerer og i noen metallurgiske prosesser.
HCN er en dødelig gift ved innånding, svelging og kontakt. Den er tilstede i sigarettrøyk og i røyken fra brannene av plast og materialer som inneholder karbon og nitrogen. Det regnes som et atmosfærisk forurensende stoff fordi det produseres under forbrenning av organisk materiale fra store områder på planeten..
Artikkelindeks
- 1 Molekylær struktur og elektronisk konfigurasjon
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Kokepunkt
- 3.5 Flammepunkt
- 3.6 Selvantennelsestemperatur
- 3.7 Tetthet
- 3.8 Løselighet
- 3.9 Dissosiasjonskonstant
- 3.10 Noen kjemiske egenskaper
- 3.11 Korrosivitet
- 4 Plassering i naturen
- 5 bruksområder
- 5.1 Ved fremstilling av andre kjemiske forbindelser og polymerer
- 5.2 Ulike bruksområder
- 5.3 I landbruket
- 6 Risiko
- 6.1 Mekanisme for dødelig handling i kroppen
- 6.2 Fare for sigarettrøyk
- 6.3 Risiko for oppvarming av HCN
- 6.4 Tilstedeværelse av HCN i brannrøyk
- 6.5 Luftforurensende stoff
- 7 Referanser
Molekylær struktur og elektronisk konfigurasjon
Hydrocyansyre eller hydrogencyanid er en kovalent, molekylær forbindelse med ett hydrogen, ett karbon og ett nitrogenatom..
Karbonatomet og nitrogenatomet deler 3 par elektroner, slik at de danner en trippelbinding. Hydrogen er bundet til karbon, som med denne bindingen presenterer valensen på fire og dens komplette elektronoktet.
Nitrogen har en valens på fem, og for å fullføre oktetten har den et par uparrede eller ensomme elektroner plassert i siden.
HCN er derfor et fullstendig lineært molekyl, med et uparret par elektroner plassert sideveis i nitrogenet..
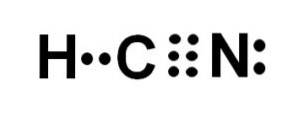
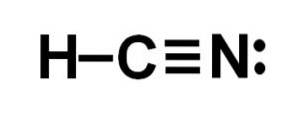
Nomenklatur
- Hydrocyanic syre
- Hydrogencyanid
- Metanonitril
- Formonitril
- Hydrocyanic syre
Eiendommer
Fysisk tilstand
Hvis den er vannfri og stabilisert under 25,6 ºC, er den en fargeløs eller lyseblå væske som er veldig ustabil og giftig. Hvis det er over den temperaturen, er det en ekstremt giftig fargeløs gass.
Molekylær vekt
27,03 g / mol
Smeltepunkt
-13,28 ºC
Kokepunkt
25,63 ºC (merk at det koker like over romtemperatur).
Flashpoint
-18 ºC (lukket koppmetode)
Selvantennelsestemperatur
538 ºC
Tetthet
0,6875 g / cm3 ved 20 ºC
Løselighet
Fullt blandbar med vann, etylalkohol og etyleter.
Dissosiasjonskonstant
K = 2,1 x 10-9
pKtil = 9.2 (det er en veldig svak syre)
Noen kjemiske egenskaper
HCN har en veldig høy dielektrisk konstant (107 til 25 ºC). Dette er fordi molekylene er veldig polære og assosieres gjennom hydrogenbindinger, som i tilfelle vann HtoELLER.
På grunn av sin høye dielektriske konstant viser HCN seg å være et godt ioniserende løsemiddel..
Vannfri vannfri HCN er veldig ustabil, den har en tendens til å polymerisere voldsomt. For å unngå dette tilsettes stabilisatorer, for eksempel en liten prosentandel av HtoSW4.
I vandig løsning og i nærvær av ammoniakk og høyt trykk danner det adenin, en forbindelse som er en del av DNA og RNA, det vil si et biologisk viktig molekyl.
Det er en veldig svak syre, siden ioniseringskonstanten er veldig liten, slik at den bare delvis ioniseres i vann, noe som gir cyanidanionet CN-. Danner salter med baser, men ikke med karbonater.
Dens vandige løsninger som ikke er beskyttet mot lys, spaltes langsomt og genererer ammoniumformiat HCOONH4.
I løsning har den en svak mandellukt.
Korrosivitet
Siden det er en svak syre, er den generelt ikke etsende.
Imidlertid angriper vandige oppløsninger av HCN som inneholder svovelsyre som en stabilisator sterkt stål ved temperaturer over 40 ° C og rustfritt stål ved temperaturer over 80 ° C..
I tillegg kan fortynnede vandige oppløsninger av HCN forårsake belastning på karbonstål selv ved romtemperatur..
Det kan også angripe noen typer gummi, plast og belegg.
Beliggenhet i naturen
Det finnes relativt rikelig i planteriket som en del av glykosider.
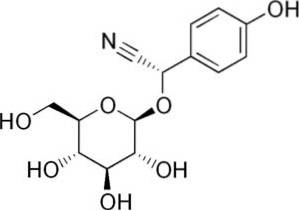
For eksempel er den generert fra amygdalin C6H5-CH (-CN) -O-glukose-O-glukose, en forbindelse tilstede i bitre mandler. Amygdalin er et cyanogent beta-glukosid, siden det hydrolyseres danner det to glukosemolekyler, en av benzaldehyd og en av HCN. Enzymet som frigjør dem er beta-glukoksidase.
Amygdalin finnes i frøene av fersken, aprikoser, bitre mandler, kirsebær og plommer..
Noen typer sorghumplanter inneholder det cyanogene glykosidet durrin (dvs. p-hydroksy- (S) -mandelonitril-beta-D-glukosid). Denne forbindelsen kan nedbrytes ved en totrinns enzymatisk hydrolyse.
For det første hydrolyserer enzymet durrinase som er endogent i sorghumplanter til glukose og p-hydroksy- (S) -mandelonitril. Sistnevnte blir så raskt omdannet til fritt HCN og p-hydroksybenzaldehyd.

HCN er ansvarlig for motstanden til sorghumplanter mot skadedyr og patogener.
Dette forklares med det faktum at durrin og enzymet durrinase har forskjellige steder i disse plantene, og de kommer bare i kontakt når vevet blir skadet eller ødelagt, og frigjør HCN og beskytter planten mot infeksjoner som kan trenge gjennom den skadede delen..
I tillegg er noen humane patogene bakterier som Pseudomonas aeruginosa Y P. gingivalis de produserer det under metabolisk aktivitet.
applikasjoner
Ved fremstilling av andre kjemiske forbindelser og polymerer
Bruken som involverer mesteparten av HCN produsert på industrielt nivå er fremstilling av mellomprodukter for organisk syntese..
Det brukes i syntesen av adiponitril NC- (CHto)4-CN, som brukes til å lage nylon, eller nylon, et polyamid. Det brukes også til å fremstille akrylnitril eller cyanoetylen CHto= CH-CN, brukt til å fremstille akrylfibre og plast.
Derivatets natriumcyanid NaCN brukes til utvinning av gull i gruvedrift av dette metallet.
Et annet av dets derivater, cyanogenkloridet ClCN, brukes til plantevernmidler.
HCN brukes til fremstilling av chelateringsmidler som EDTA (etylen-diamin-tetraacetat).
Den brukes til fremstilling av ferrocyanider og noen farmasøytiske produkter.
Ulike bruksområder
HCN-gass har blitt brukt som insektmiddel, soppdrepende middel og desinfeksjonsmiddel, for gassing av skip og bygninger. Også å fumigere møbler for å gjenopprette dem.
HCN har blitt brukt i polering av metall, galvanisering av metall, fotografiske prosesser og metallurgiske prosesser..
På grunn av sin høye toksisitet ble den utpekt som et kjemisk krigsføringsmiddel..
I landbruket
Det har blitt brukt som ugressmiddel og plantevernmiddel i frukthager. Den ble brukt til å kontrollere skjell og andre patogener på sitrustrær, men noen av disse skadedyrene har blitt resistente mot HCN.
Det har også blitt brukt til å fumigere kornsiloer. HCN-gass som er tilberedt på stedet, har blitt brukt til røyking av hvetekorn for å bevare dem mot skadedyr som insekter, sopp og gnagere. For denne bruken er det viktig at frøene som skal fumeres tåler plantevernmidlet..
Testing har blitt gjort ved å spraye hvetefrø med HCN, og det har blitt funnet at det ikke påvirker spiringspotensialet negativt, det ser ut til å favorisere det..
Imidlertid kan høye doser HCN redusere lengden på de små bladene som spirer fra frøet betydelig..
På den annen side, på grunn av det faktum at det er et kraftig nematicid og at noen sorghumplanter har det i vevet sitt, undersøkes potensialet for sorghumplanter til å bli brukt som biocid grønn gjødsel..
Dens bruk vil tjene til å forbedre jord, undertrykke ugress og kontrollere sykdommer og skader forårsaket av fytoparasittiske nematoder..
Risiko
For mennesker er HCN en dødelig gift på alle måter: innånding, svelging og kontakt..

Innånding kan være dødelig. Det anslås at om lag 60-70% av befolkningen kan oppdage den bitre mandellukten av HCN når den er i luft i en konsentrasjon på 1-5 ppm.
Men det er 20% av befolkningen som ikke kan oppdage det selv i dødelige konsentrasjoner fordi de genetisk ikke er i stand til å gjøre det.
Inntatt er det en akutt og øyeblikkelig virkende gift..
Hvis løsningene deres kommer i kontakt med huden, kan det assosierte cyanidet være dødelig.
HCN er tilstede i sigarettrøyk og som dannes når nitrogenholdig plast blir brent.
Dødelig virkningsmekanisme i kroppen
Det er en kjemisk kvælningsmiddel og er raskt giftig, og fører ofte til døden. Når den kommer inn i kroppen, binder den seg til metalloenzymer (enzymer som inneholder et metallion), og inaktiverer dem. Det er et giftig middel for ulike organer i menneskekroppen
Dens viktigste toksiske effekt består i inhibering av cellulær respirasjon, siden den deaktiverer et enzym som påvirker fosforylering i mitokondrier, som er organeller som blant annet griper inn i cellens luftveisfunksjon..
Fare for sigarettrøyk
HCN er tilstede i sigarettrøyk.
Selv om mange kjenner den forgiftende effekten av HCN, er det få som er klar over at de blir utsatt for skadelig effekt gjennom sigarettrøyk..
HCN er en av årsakene til inhibering av flere cellulære respiratoriske enzymer. Mengden HCN i sigarettrøyk har en særlig skadelig effekt på nervesystemet..
HCN-nivåer i sigarettrøyk er rapportert mellom 10 og 400 μg per sigarett for direkte inhalert røyk og 0,006 til 0,27 μg / sigarett for sekundær innånding (passiv røyking). HCN gir giftige effekter fra 40 μM og utover.

Ved innånding kommer den raskt inn i blodbanen, der den frigjøres i plasma eller binder seg til hemoglobin. En liten del omdannes til tiocyanat og skilles ut i urinen.
Risiko for HCN-oppvarming
Langvarig eksponering for varme av flytende HCN i lukkede beholdere kan føre til uventet voldsomt brudd på beholderne. Kan polymerisere eksplosivt ved 50-60 ° C i nærvær av spor av alkali og i fravær av inhibitorer.
Tilstedeværelse av HCN i røyk fra branner
HCN frigjøres under forbrenning av nitrogenholdige polymerer, som ull, silke, polyakrylnitriler og nylon, blant andre. Disse materialene er til stede i våre hjem og de fleste steder for menneskelig aktivitet.
Av denne grunn kan HCN potensielt være dødsårsaken ved innånding under brann..
Forurensning av atmosfæren
HCN er et forurensende stoff i troposfæren. Den er motstandsdyktig mot fotolyse, og under miljøforholdene i atmosfæren gjennomgår den ikke hydrolyse.
Fotokjemisk produserte hydroksyl OH • radikaler kan reagere med HCN, men reaksjonen er veldig langsom, så halveringstiden til HCN i atmosfæren er 2 år.
Når biomasse, spesielt torv, blir brent, frigjøres HCN i atmosfæren, og også under industrielle aktiviteter. Forbrenningen av torv er imidlertid 5 til 10 ganger mer forurensende enn forbrenning av andre typer biomasse.
Noen forskere har funnet ut at de høye temperaturene og tørken forårsaket av El Niño-fenomenet i visse områder av planeten forverrer sesongbrann i områder med høyt innhold av nedbrutt plantemateriale..

Dette fører til intens biomasseforbrenning i tørre årstider..
Disse hendelsene er kilden til høye konsentrasjoner av HCN i troposfæren, som til slutt blir transportert til den nedre stratosfæren, og forblir i veldig lang tid..
Referanser
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- OSS. National Library of Medicine. (2019). Hydrogencyanid. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Gidlow, D. (2017). Hydrogencyanid - en oppdatering. Yrkesmedisin 2017; 67: 662-663. Gjenopprettet fra ncbi.nlm.nih.gov.
- Van Nostrands vitenskapelige leksikon. (2005). Hydrogencyanid. 9th Gjenopprettet fra onlinelibrary.wiley.com.
- Ren, Y.-L. et al. (nitten nittiseks). Effekt av hydrogencyanid og karbonylsulfid på spiring og hvetekraft. Pestic. Sci. 1996, 47, 1-5. Gjenopprettet fra onlinelibrary.wiley.com.
- Fra Nicola, G.R. et al. (2011). En enkel analytisk metode for evaluering av innhold av dhurrin i cyanogene planter for deres bruk i fôr og bioforgiftning. J. Agric. Food Chem. 2011, 59, 8065-8069. Gjenopprettet fra pubs.acs.org.
- Sheese, P.E. et al. (2017). En global forbedring av hydrogencyanid i den nedre stratosfæren gjennom hele 2016. Geophys. Res. Lett., 44, 5791-5797. Gjenopprettet fra agupubs.onlinelibrary.wiley.com.
- Surleva, A.R. og Drochioiu, G. (2013). Visualisering av røykefare: En enkel spektrofotometrisk bestemmelse av hydrogencyanid i sigarettrøyk og filtre. J. Chem. Educ. 2013, 90, 1654-1657. Gjenopprettet fra pubs.acs.org.
- Alarie, Y. et al. (1990). Rollen av hydrogencyanid i menneskedødsfall i brann. I brann og polymerer. Kapittel 3. ACS Symposium Series. Gjenopprettet fra pubs.acs.org.



Ingen har kommentert denne artikkelen ennå.