
Fosforsyre (H3PO4) struktur, egenskaper, bruksområder

De fosforsyre Det er en oksosyre av fosfor som har den kjemiske formelen H3PO4. Den består av en mineralsyre der tre sure protoner er bundet til fosfatanionen (PO43-). Selv om den ikke betraktes som en sterk syre, kan feil bruk den utgjøre en helserisiko.
Det finnes i to tilstander: som et fast stoff i form av tykke ortorombiske krystaller, eller en krystallinsk væske med et sirupaktig utseende. Den vanligste kommersielle presentasjonen har en konsentrasjon på 85% w / w og en tetthet på 1,685 g / cm3. Denne tettheten kommer fra konsentrasjonshånden.
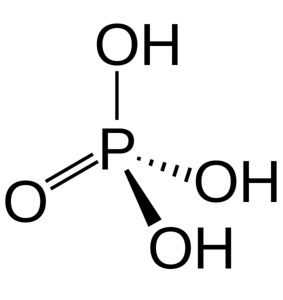
De tre OH-gruppene er ansvarlige for donasjon av sure hydrogener. På grunn av tilstedeværelsen av dem i strukturen, kan den reagere med forskjellige hydroksider som har forskjellige salter.
Når det gjelder natriumhydroksid, kan det danne tre: monobasisk natriumfosfat (NaHtoPO4), dibasisk natriumfosfat (NatoHPO4) og tribasisk natriumfosfat (Na3PO4).
Avhengig av hvilken base som brukes for nøytralisering, eller hvilke kationer som er veldig nær den, kan den imidlertid danne andre fosfatsalter. Blant dem er: kalsiumfosfat (Ca3(PO4)to), litiumfosfat (Li3PO4), jernfosfat (FePO4), og andre. Hver og en med sine forskjellige grader av protonering av fosfatanionen.
På den annen side kan fosforsyre "sekvestre" toverdige kationer som Feto+, Cuto+, ACto+ og Mgto+. Ved forhøyede temperaturer kan den reagere med seg selv med tap av et H-molekyltoEller danner dimerer, trimerer og polymerer av fosforsyrer.
Denne typen reaksjon gjør denne forbindelsen i stand til å etablere et stort antall strukturer med fosfor og oksygenskjeletter, hvorfra det også kan oppnås et bredt spekter av salter kjent som polyfosfater..
Når det gjelder oppdagelsen, ble den syntetisert i 1694 av Robert Boyle, og oppløste PtoELLER5 (fosforpentoksid) i vann. Det er en av de mest nyttige mineralsyrene, og dens funksjon som gjødsel er den viktigste. Fosfor, sammen med kalium og nitrogen, utgjør de tre viktigste plante næringsstoffene.
Artikkelindeks
- 1 Kjemisk struktur
- 1.1 Difosforsyre (H4P2O7)
- 1.2 Polyfosforsyrer
- 1.3 Sykliske polyfosforsyrer
- 2 Nomenklatur
- 2.1 Ortho
- 2.2 Pyro
- 2.3 Mål
- 3 eiendommer
- 3.1 Molekylformel
- 3.2 Molekylvekt
- 3.3 Fysisk utseende
- 3.4 Koke- og smeltepunkter
- 3.5 Løselighet i vann
- 3.6 Tetthet
- 3.7 Damptetthet
- 3.8 Selvantennelse
- 3.9 Viskositet
- 3.10 Surhet
- 3.11 Nedbrytning
- 3.12 Korrosivitet
- 3.13 Polymerisering
- 4 bruksområder
- 4.1 Fosfatsalter og generell bruk
- 4.2 Industriell
- 4.3 Dental
- 4.4 Kosmetikk
- 5 Dannelse av fosforsyre
- 6 Risiko
- 7 Referanser
Kjemisk struktur
Fosforsyre består av en P = O-binding og tre P-OH, hvor sistnevnte er bærerne av de sure hydrogenene som frigjøres i et oppløsningsmedium. Med fosforatomet i sentrum trekker oksygene en slags molekylær tetraeder.
På denne måten kan fosforsyre visualiseres som et tetraeder. Fra dette perspektivet, sa tetraedra (av enheter av H3PO4) samhandle med hverandre gjennom hydrogenbindinger; det vil si at dens topppunkter er omtrentlige.
Disse intermolekylære interaksjonene tillater fosforsyre å krystallisere til to faste stoffer: det vannfrie og hemihydratet (H3PO41 / 2HtoO), begge med monokliniske krystallsystemer. Dens vannfrie form kan også beskrives med formelen: 3HtoO · PtoELLER5, som er lik et trihydratert fosforpentoksyd.
Tetrahedra kan til og med bli kovalent bundet, men for dette må en av enhetene deres eliminere et vannmolekyl gjennom dehydrering. Dette skjer når H3PO4 blir utsatt for oppvarming, og genererer følgelig dannelsen av polyfosforsyrer (PA).
Difosforsyre (H4PtoELLER7)
Den enkleste av alle PA er difosforsyre (H4PtoELLER7), også kjent som pyrofosforsyre. Den kjemiske ligningen for dannelsen er som følger:
2H3PO4 <=> H4PtoELLER7 + HtoELLER
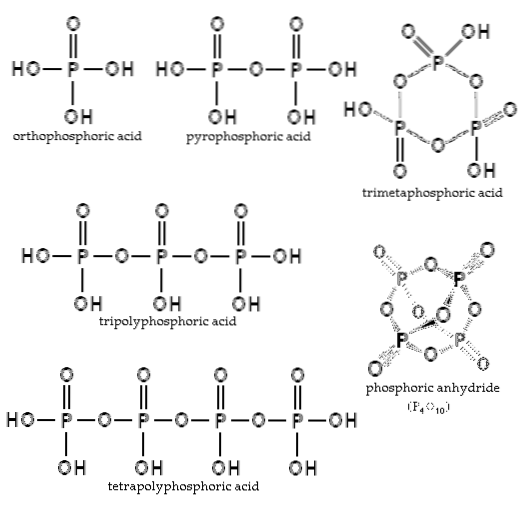
Balansen avhenger av vannmengden og temperaturen. Hva er strukturen? I bildet av seksjonen er strukturene av ortofosforsyre og pyrofosforsyre illustrert i øvre venstre hjørne..
To enheter kobles sammen kovalent når et vannmolekyl elimineres, og danner en P-O-P oksygenbro mellom dem. Nå er de ikke tre sure hydrogener, men fire (fire -OH-grupper). På grunn av dette har H4PtoELLER7 har fire ioniseringskonstanter ktil.
Polyfosforsyrer
Dehydrering kan fortsette med pyrofosforsyre hvis oppvarmingen fortsetter. Hvorfor? Fordi det i hver ende av molekylet er en OH-gruppe som kan fjernes som et vannmolekyl, og dermed fremme den påfølgende veksten av P-O-P-O-P skjelettet ...
Eksempler på disse syrene er tripolyfosforsyre og tetrapolyfosforsyre (begge illustrert på bildet). Det kan sees hvordan P-O-P-ryggraden forlenger i en slags kjede som består av tetraeder.
Disse forbindelsene kan være representert med formelen HO (POtoÅH)xH, hvor HO er ytterste venstre som kan bli dehydrert. POtoOH er fosfor-ryggraden med P = O- og OH-bindinger; og x er enhetene eller molekylene av fosforsyrer som er nødvendige for å oppnå kjeden.
Når disse forbindelsene er nøytralisert med en base, dannes såkalte polyfosfater. Avhengig av hvilke kationer som omgir dem, danner de et bredt utvalg av polyfosfatsalter.
På den annen side, hvis de reagerer med ROH-alkoholer, erstattes ryggradsvatrogenene med R-alkylsubstituentene. Dermed oppstår fosfatestere (eller polyfosfater): RO (POtoELLER)xR. Det er nok å erstatte H med R i alle strukturene i bildet av seksjonen for å få dem.
Sykliske polyfosforsyrer
P-O-P-kjedene kan til og med lukke på en fosforring eller syklus. Den enkleste av denne typen forbindelser er trimetafosforsyre (øvre høyre hjørne av bildet). Dermed kan AP være lineære, sykliske; eller hvis strukturene deres har begge typer, forgrenet.
Nomenklatur
Nomenklaturen for fosforsyre er diktert av IUPAC og hvordan de ternære saltene av oksosyrer heter.
Fordi i H3PO4 P-atomet har valens +5, den høyeste verdien, dets syre tildeles suffikset -ico til prefikset fosfor-.
Ortho
Imidlertid kalles fosforsyre også ofte ortofosforsyre. Hvorfor? Fordi ordet 'ortho' er gresk og betyr 'sant'; som vil oversettes til den "sanne formen" eller "mer hydrert" av den samme.
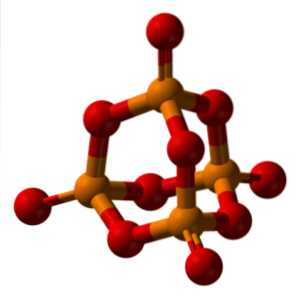
Når vannfri fosforsyre er hydrert med et overskudd av vann (P4ELLER10, fosfor "hetten" på bildet ovenfor) produseres H3PO4 (3HtoO · PtoELLER5). Således tilordnes prefikset ortho de syrene som dannes med rikelig med vann.
Pyro
Prefikset pyro refererer til enhver forbindelse som stammer fra påføring av varme, siden difosforsyre oppstår ved termisk dehydrering av fosforsyre. Det kalles derfor pyrofosforsyre (2HtoO · PtoELLER5).
Mål
Prefikset meta, som også er et gresk ord, betyr 'etter'. Det tilsettes de stoffene hvis formel har eliminert et molekyl, i dette tilfellet, det av vann:
H3PO4 => HPO3 + HtoELLER
Legg merke til at denne gangen tilsetning av to fosforsenheter ikke forekommer for å danne fosforsyre, men i stedet oppnås metafosforsyre (som det ikke er bevis for at den eksisterer).
Det er også viktig å merke seg at denne syren kan beskrives som HtoO · PtoELLER5 (ligner på hemidrat, multipliserende HPO3 For 2). Metaprefikset er helt i tråd med syklisk PA, siden hvis trifosforsyren dehydrerer, men ikke tilfører en annen H-enhet3PO4 for å bli tetrafosforsyre, så må den danne en ring.
Og dette er det samme med andre polymetafosforsyrer, selv om IUPAC anbefaler å kalle dem sykliske forbindelser av de tilsvarende PA-ene..
Eiendommer
Molekylær formel
H3PO4
Molekylær vekt
97,994 g / mol
Fysisk utseende
I sin faste form presenterer den ortorhombiske, hygroskopiske og gjennomsiktige krystaller. I flytende form er den krystallinsk med utseende av en tyktflytende sirup..
Den er kommersielt tilgjengelig i vandig oppløsning med en konsentrasjon på 85 vekt%. I alle disse presentasjonene mangler det lukt.
Koke- og smeltepunkter
158 ° C (316 ° F ved 760 mmHg).
42,2 ° C.
Vannløselighet
548 g / 100 g HtoEller ved 20 ° C; 369,4 g / 100 ml ved 0,5 ° C; 446 g / 100 m ved 14,95 ° C.
Tetthet
1892 g / cm3 (fast); 1,841 g / cm3 (100% løsning); 1,685 g / cm3 (85% løsning); 1.334 g / cm3 50% løsning) ved 25 ° C.
Damptetthet
I forhold til luft 3,4 (luft = 1).
Selvantennelse
Det er ikke brannfarlig.
Viskositet
3,86 mPoise (40% løsning ved 20 ° C).
Surhet
pH: 1,5 (0,1 N løsning i vann)
pKa: pKal = 2.148; pKa2 = 7.198 og pKa3 = 12.319. Derfor er det sureste hydrogenet ditt det første.
Nedbrytning
Ved oppvarming frigjør den fosforoksider. Hvis temperaturen stiger til 213 ° C eller mer, blir det pyrofosforsyre (H4PtoELLER7).
Korrosivitet
Etsende for jernholdige metaller og aluminium. Reaksjon med disse metallene gir drivstoffgass hydrogen.
Polymerisering
Polymeriserer voldsomt med azoforbindelser, epoksider og polymeriserbare forbindelser.
applikasjoner
Fosfatsalter og generell bruk
-Fosforsyre tjener som grunnlag for å lage fosfater, som brukes som gjødsel fordi fosfor er et hovednæringsstoff i planter..
-Det har blitt brukt til behandling av blyforgiftning og andre forhold der det kreves betydelige mengder fosfat og produksjon av mild acidose..
-Den brukes til å kontrollere pH i mink og urinveiene for å unngå dannelse av nyrestein.
-Fosforsyre gir opphav til Na-saltertoHPO4 og NaHtoPO4 som utgjør et pH-buffersystem med en pKa på 6,8. Dette pH-reguleringssystemet er tilstede hos mennesker, og er viktig i reguleringen av intracellulær pH, så vel som i styringen av hydrogenkonsentrasjonen i de distale og oppsamlende tubuli i nefronene..
-Den brukes til fjerning av det mugne laget av jernoksid som akkumuleres på dette metallet. Fosforsyre danner jernfosfat som lett kan fjernes fra metalloverflaten. Den brukes også til elektrisk polering av aluminium og er et bindemiddel for ildfaste produkter som aluminiumoksyd og magnesia..
Industriell
-Fosforsyre brukes som et katalytisk middel ved fremstilling av nylon og bensin. Det brukes som et dehydratiseringsmiddel i litografisk gravering, i produksjonen av fargestoffer for bruk i tekstilindustrien, i latexkoagulasjonsprosessen i gummiindustrien og i rensing av hydrogenperoksid.
-Syren brukes som tilsetningsstoff i kullsyreholdige drikker, og bidrar dermed til smaken. Fortynnet påføres i sukkerraffineringsprosessen. Det fungerer også som et buffersystem ved tilberedning av skinke, gelatin og antibiotika..
-Det er involvert i produksjonen av vaskemidler, i syrekatalysen av acetylenproduksjon.
-Det brukes som et suremiddel i balansert mat til husdyrindustrien og kjæledyr. Den farmasøytiske industrien bruker den til fremstilling av antiemetiske legemidler. Det brukes også i en blanding for å lage asfalt for å bane bakken og reparere sprekker..
-Fosforsyre fungerer som en katalysator i hydratiseringsreaksjonen av alkener for å produsere alkohol, hovedsakelig etanol. I tillegg brukes den til bestemmelse av organisk karbon i jord.
Dental
Det brukes av tannleger for å rengjøre og kondisjonere tannoverflaten før plassering av tannregulering. Det finner også bruk i tannbleking og fjerning av tannplakk. I tillegg brukes den til fremstilling av lim for tannproteser.
Kosmetikk
Fosforsyre brukes til å justere pH i kosmetiske produkter og hudpleieprodukter. Det brukes som et kjemisk oksidasjonsmiddel for produksjon av aktivert karbon..
Dannelse av fosforsyre
-Fosforsyre fremstilles av fosfatbergarter av apatitt-typen ved fordøyelse med konsentrert svovelsyre:
AC3(PO4)to + 3 HtoSW4 + 6 timertoO => 2 H3PO4 + 3 (CaSO4.2HtoELLER)
Fosforsyren oppnådd i denne reaksjonen har lav renhet, så den gjennomgår en renseprosess som inkluderer utfelling, løsningsmiddelekstraksjon, krystallisering og ionebytte teknikker..
-Fosforsyre kan produseres ved å oppløse fosforpentoksid i kokende vann.
-Det kan også oppnås ved å varme opp fosfor med en blanding av luft og vanndamp:
P4 (l) + 5 Oto (g) => P4ELLER10 (s)
P4ELLER10 (s) + HtoO (g) => 4H3PO4 (l)
Risiko
-Fordi damptrykket er lavt ved romtemperatur, er det lite sannsynlig at dampene inhaleres med mindre syre sprayes. I så fall inkluderer inhalasjonssymptomene: hoste, ondt i halsen, kortpustethet og anstrengt pust..
-Litteraturen siterer tilfellet med en sjømann som ble utsatt for fosforsyredamp i lang tid. Han fikk generell svakhet, tørr hoste, smerter i brystet og pusteproblemer. Innen ett år etter eksponering ble reaktiv luftveisdysfunksjon observert.
-Hudkontakt med fosforsyre kan forårsake rødhet, smerte, blemmer og forbrenninger i huden..
-Syrens kontakt med øynene, avhengig av konsentrasjonen og varigheten av kontakten, kan forårsake etsende vevsskader eller alvorlige etseskader med permanent øyeskade..
-Svelging av syren forårsaker svie i munnen og halsen, en brennende følelse utover brystbenet, magesmerter, oppkast, sjokk og kollaps.
Referanser
- Royal Society of Chemistry. (2015). Fosforsyre. Hentet fra: chemspider.com
- Canadian Center for Occupational Safety and Health. (1999). Fosforsyre - helseeffekter. Hentet fra: ccsso.ca
- Acids.Info. (2018). Fosforsyre "En rekke bruksområder av denne kjemiske forbindelsen. Hentet fra: acidos.info
- James P. Smith, Walter E. Brown og James R. Lehr. (1955). Struktur av krystallinsk fosforsyre. J. Am. Chem. Soc. 77, 10, 2728-2730
- Wikipedia. (2018). Fosforsyrer og fosfater. Hentet fra: en.wikipedia.org
- Vitenskap er gøy. Lær om fosforsyre. [PDF]. Hentet fra: scifun.chem.wisc.edu



Ingen har kommentert denne artikkelen ennå.