
Hyposulfurøse syreformler, egenskaper og bruksområder
De hyposulfurous syre eller dithionsyre er ukjent, ustabil i ren form, har ingen uavhengig eksistens og har ikke blitt påvist i vandig løsning.
Teoretisk sett vil det være en relativt svak syre, sammenlignbar med svovelsyre, H2SO3. Bare saltene er kjent, ditionittene, som er stabile og kraftige reduksjonsmidler. Natriumsaltet av ditionsyre er natrium ditionitt.

- Formler
| dionøs syre | ditionittanion | natrium ditionitt | |
| Formler | H2S2O4 | S2O42− | Na2S2O4 |
- CAS: 20196-46-7 hyposulfurøs (eller dithionøs) syre
- CAS: 14844-07-6 hyposulfurous acid (eller dithionous, ion)
- CAS: 7775-14-6 natrium ditionitt (natriumsalt av ditionsyre)
2D-struktur
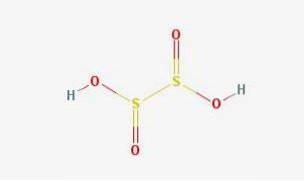
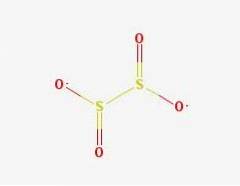
3D-struktur
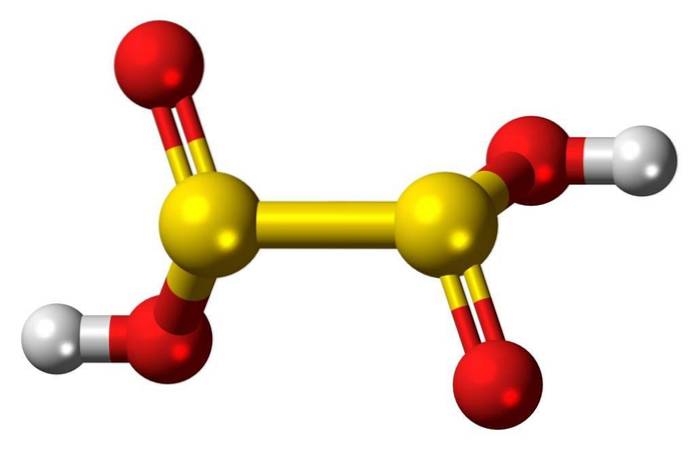
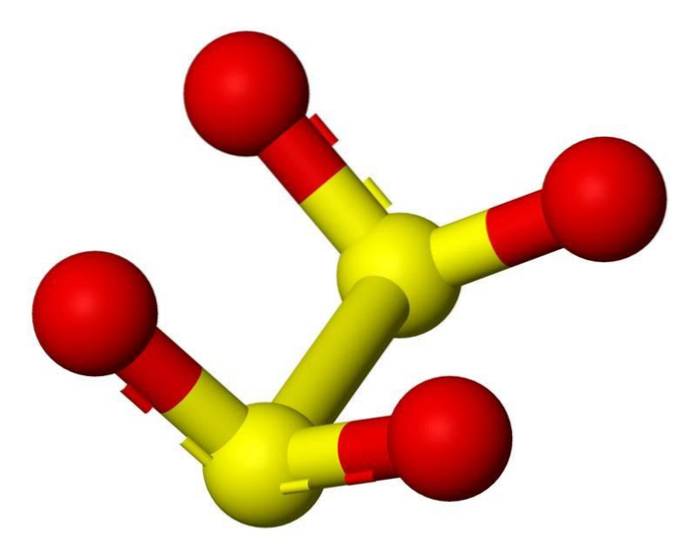
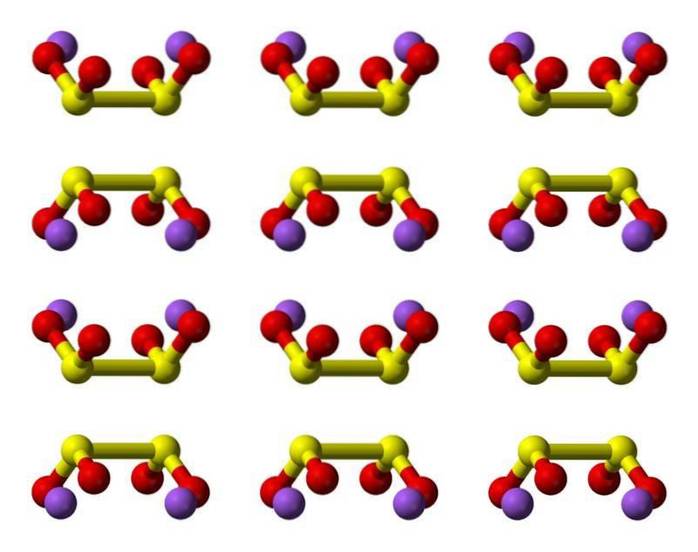
Kjennetegn
Fysiske og kjemiske egenskaper
| dionøs syre | ditionittanion | natrium ditionitt | |
| Utseende: | . | . | Hvitt til off-white krystallinsk pulver |
| . | . | Lette sitronflak | |
| Lukt: | . | . | Svak svovellukt |
| Molekylær vekt: | 130,132 g / mol | 128,116 g / mol | 174,096 g / mol |
| Kokepunkt: | . | . | Det nedbrytes |
| Smeltepunkt: | . | . | 52 ° C |
| Tetthet: | . | . | 2,38 g / cm3 (vannfri) |
| Vannløselighet | . | . | 18,2 g / 100 ml (vannfri, 20 ° C) |
Hyposulfurous acid er en svoveloksosyre med den kjemiske formelen H2S2O4.
Svoveloksosyrer er kjemiske forbindelser som inneholder svovel, oksygen og hydrogen. Noen av dem er imidlertid bare kjent fra saltene deres (som for eksempel svovelsyre, ditionsyre, disulfidsyre og svovelsyre).
Blant de strukturelle egenskapene til oksosyrene som har blitt karakterisert, har vi:
- Tetrahedral svovel når det koordineres med oksygen
- Bro og terminale oksygenatomer
- Terminal peroxogrupper
- S = S terminaler
- Strenger av (-S-) n
Svovelsyre er den mest kjente svoveloksosyren og den viktigste industrielt.
Ditionittanionet ([S2O4] 2-) er en oksoanion (et ion med den generiske formelen AXOY z-) av svovel formelt avledet fra ditionsyre.
Ditionittioner gjennomgår både sur og alkalisk hydrolyse til henholdsvis tiosulfat og bisulfitt, og sulfitt og sulfid:
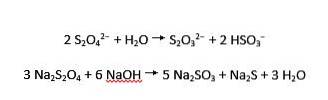
Natriumsaltet av ditionsyre er natrium ditionitt (også kjent som natriumhydrosulfitt).
Sodium ditionitt er et hvitt til lysegult krystallinsk pulver som har en lukt som ligner svoveldioksid..
Det varmes opp spontant ved kontakt med luft og fuktighet. Denne varmen kan være nok til å antenne de omgivende brennbare materialene..
Ved langvarig eksponering for ild eller sterk varme kan beholdere med dette materialet sprekke voldsomt..
Det brukes som reduksjonsmiddel og som blekemiddel. Den brukes og til bleking av papirmasse og til farging. Det brukes også til å redusere nitrogruppen til en aminogruppe i organiske reaksjoner..
Selv om det er stabilt under de fleste forhold, spaltes det i varmt vann og syreoppløsninger.
Det kan fås fra natriumbisulfitt ved følgende reaksjon:
2 NaHSO3 + Zn → Na2S2O4 + Zn (OH) ²
Luft- og vannreaksjoner
Sodium ditionitt er et brennbart fast stoff som langsomt spaltes ved kontakt med vann eller vanndamp og danner tiosulfater og bisulfitter..
Denne reaksjonen gir varme, noe som kan akselerere reaksjonen ytterligere eller føre til at omgivende materialer brenner seg. Hvis blandingen er begrenset, kan nedbrytningsreaksjonen resultere i trykksetting av beholderen, som kan sprekke kraftig. Holder seg i luften, oksiderer den sakte og genererer giftige svoveldioksidgasser.
Brannfare
Sodium ditionitt er et brennbart og brennbart materiale. Kan antennes ved kontakt med fuktig luft eller fuktighet. Det kan brenne raskt med blusseffekt. Kan reagere kraftig eller eksplosivt i kontakt med vann.
Kan spres eksplosivt ved oppvarming eller brann. Det kan antennes på nytt etter at brannen er slukket. Avrenning kan skape brann- eller eksplosjonsfare. Beholdere kan eksplodere ved oppvarming.
Helserisiko
Ved kontakt med brann vil Sodium Dithionite produsere irriterende, etsende og / eller giftige gasser. Innånding av nedbrytningsprodukter kan forårsake alvorlig personskade eller død. Kontakt med stoffet kan forårsake alvorlige etseskader på hud og øyne. Avrenning fra brannkontroll kan forårsake forurensning.
applikasjoner
Ditionittionet brukes, ofte i forbindelse med et kompleksdannende middel (f.eks. Sitronsyre), for å redusere jern (III) oksyhydroksid til løselig jern (II) forbindelser og fjerne amorfe jernholdige mineralfaser (III) i jordanalyse (selektiv ekstraksjon ).
Dionionitt øker løseligheten av jern. Takket være den sterke affiniteten til ditionittionen til toverdige og treverdige metallkationer, brukes den som et chelateringsmiddel..
Nedbrytningen av ditionitt gir reduserte svovelarter som kan være svært aggressive for korrosjonen av stål og rustfritt stål..
Blant anvendelsene av natrium ditionitt har vi:
I bransjen
Denne forbindelsen er et vannløselig salt og kan brukes som et reduksjonsmiddel i vandige oppløsninger. Det brukes som sådan i noen industrielle fargeprosesser, hovedsakelig de som involverer svovelfarger og karfargestoffer, der et vannuoppløselig fargestoff kan reduseres til et vannløselig alkalimetallsalt (for eksempel indigofargen).
De reduserende egenskapene til natriumdionitt fjerner også overflødig fargestoff, gjenværende oksid og uønskede pigmenter, og forbedrer dermed den generelle fargekvaliteten..
Sodium ditionitt kan også brukes til vannbehandling, gassrensing, rengjøring og utvinning. Den kan også brukes i industrielle prosesser som et sulfonerende middel eller en kilde til natriumion.
I tillegg til tekstilindustrien, brukes denne forbindelsen i næringer relatert til lær, mat, polymerer, fotografering og mange andre. Brukes også som blekemiddel i organiske reaksjoner.
I de biologiske vitenskapene
Sodium ditionitt brukes ofte i fysiologiske eksperimenter som et middel for å redusere redokspotensialet til løsninger..
I geologiske vitenskaper
Natriumdionitt brukes ofte i jordkjemiske eksperimenter for å bestemme mengden jern som ikke er innlemmet i primære silikatmineraler..
Sikkerhet og risiko
Faresetninger fra det globalt harmoniserte systemet for klassifisering og merking av kjemikalier (GHS)
Det globalt harmoniserte systemet for klassifisering og merking av kjemikalier (GHS) er et internasjonalt avtalt system, laget av FN og designet for å erstatte de forskjellige klassifiserings- og merkingsstandardene som brukes i forskjellige land ved å bruke konsistente kriterier globalt..
Risikoklassene (og deres tilsvarende GHS-kapittel), standarder for klassifisering og merking og anbefalinger for natriumdionitt er som følger (European Chemicals Agency, 2017; FN, 2015; PubChem, 2017):



Referanser
- Benjah-bmm27, (2006). En ball-and-stick-modell av ditionittionen [bilde] Gjenopprettet fra wikipedia.org.
- Drozdova, Y., Steudel, R., Hertwig, R. H., Koch, W., & Steiger, T. (1998). Strukturer og energier til forskjellige isomerer av dinionsyre, H2S2O4, og dets anion HS2O4-1. Journal of Physical Chemistry A, 102 (6), 990-996. Gjenopprettet fra: mycrandall.ca
- European Chemicals Agency (ECHA). (2017). Sammendrag av klassifisering og merking. Harmonisert klassifisering - Vedlegg VI til forordning (EF) nr. 1272/2008 (CLP-forordningen). Sodium ditionitt, natriumhydrosulfitt. Hentet 2. februar 2017 fra: echa.europa.eu
- Jynto (diskusjon), (2011). Dithionous-acid-3D-balls [image] Gjenopprettet fra: https://en.wikipedia.org/wiki/Dithionous_acid#/media/File:Dithionous-acid-3D-balls.png
- LHcheM, (2012). Eksempel på natrium ditionitt [bilde] Gjenopprettet fra: wikipedia.org.
- Mills, B. (2009). Sodium-dionionite-xtal-1992-3D-balls [image] Gjenopprettet fra: wikipedia.org.
- FN (2015). Globalt harmonisert system for klassifisering og merking av kjemikalier (GHS) sjette reviderte utgave. New York, EU: FNs publikasjon. Gjenopprettet fra: unece.orgl
- Nasjonalt senter for bioteknologisk informasjon. PubChem Compound Database. (2017). Ditionitt. Bethesda, MD, EU: National Library of Medicine. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov.
- Nasjonalt senter for bioteknologisk informasjon. PubChem Compound Database. (2017). Dionøs syre. Bethesda, MD, EU: National Library of Medicine. Gjenopprettet fra: nih.gov.
- Nasjonalt senter for bioteknologisk informasjon. PubChem Compound Database. (2017). Sodium ditionitt. Bethesda, MD, EU: National Library of Medicine. Gjenopprettet fra: nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Kjemisk datablad. Sodium ditionitt. Silver Spring, MD. EU; Gjenopprettet fra: cameochemicals.noaa.gov
- PubChem, (2016). Dionionitt [bilde] Gjenopprettet fra: nih.gov.
- PubChem, (2016). Dionionitt [bilde] Gjenopprettet fra: nih.gov.
- PubChem, (2016). Dithionous acid [image] Gjenopprettet fra: nih.gov.
- Wikipedia. (2017). Ditionitt. Hentet 2. februar 2017 fra: wikipedia.org.
- Wikipedia. (2017). Dithionous_acid. Hentet 2. februar 2017 fra: wikipedia.org.
- Wikipedia. (2017). Oxyanion. Hentet 2. februar 2017 fra: wikipedia.org.
- Wikipedia. (2017). Sodium ditionitt. Hentet 2. februar 2017 fra: wikipedia.org.
- Wikipedia. (2017). Svoveloksosyre. Hentet 2. februar 2017 fra: wikipedia.org.



Ingen har kommentert denne artikkelen ennå.