
Kjemiske kinetikkfaktorer, reaksjonsrekkefølge og anvendelser
De kjemisk kinetikk Det er studiet av hastighetene til en reaksjon. Dra ned eksperimentelle eller teoretiske data om molekylærmekanismen, gjennom lover uttrykt ved matematiske ligninger. Mekanismer består av en serie trinn, hvorav noen er raske og noen er sakte..
Den tregeste av disse kalles hastighetsbestemmende trinn. Derfor er det veldig viktig å kjenne den mellomliggende arten og driftsmekanismen til dette trinnet i kinetiske termer. En visualisering av det ovennevnte er å anta at reagensene er innesluttet i en flaske, og at når produktene reagerer, slipper de ut på utsiden.

Til slutt kommer produktene fritt fra munnen på flasken uten ytterligere kinetiske hindringer. Fra dette perspektivet er det flasker i mange størrelser og design. Imidlertid har de alle ett element til felles: en smal nakke, en indikator på det avgjørende trinnet i reaksjonen..
Artikkelindeks
- 1 Hva studerer kjemisk kinetikk?
- 2 Reaksjonshastighet
- 2.1 Definisjon
- 2.2 Generell ligning
- 2.3 Desserteksempel
- 2.4 Hvordan bestemme det
- 3 faktorer som påvirker reaksjonshastighet
- 3.1 Naturen til kjemiske arter
- 3.2 Konsentrasjon av reagenser
- 3.3 Temperatur
- 4 Reaksjonsrekkefølge i kjemisk kinetikk
- 4.1 Nullordensreaksjoner
- 4.2 Første ordens reaksjon
- 4.3 Andreordens reaksjon
- 4.4 Reaksjonsrekkefølge kontra molekylæritet
- 5 Søknader
- 6 Referanser
Hva studerer kjemisk kinetikk?
Eksperimentelt studerer denne grenen av kjemi konsentrasjonsvariasjonene involvert i en kjemisk reaksjon, fra måling av en bestemt egenskap.
Kjemisk kinetikk er den grenen av kjemi som har ansvaret for å studere all informasjon som kan hentes fra reaksjonshastigheten. Navnet inviterer deg til å forestille deg et lommeur som markerer tiden for en prosess, uansett hvor den skjer: i en reaktor, i en sky, i en elv, i menneskekroppen etc..
Alle kjemiske reaksjoner, og derfor all transformasjon, har termodynamiske, likevektige og kinetiske aspekter. Termodynamikk indikerer om en reaksjon er spontan eller ikke; balansen dens grad av kvantifisering; og kinetikk forholdene som favoriserer hastigheten og samt data om mekanismen.
Mange av de viktigste aspektene ved kjemisk kinetikk kan observeres i det daglige: i kjøleskapet, som fryser mat for å redusere nedbrytningen ved å fryse vannet som inngår i det. Også i modningen av vinene, hvis aldring gir den sine behagelige smaker.
Imidlertid er "tiden for molekyler" veldig forskjellig i sine små skalaer, og varierer enormt etter mange faktorer (antall og typer bindinger, størrelser, tilstandstilstander osv.).
Fordi tid er liv, og det er også penger, er det ytterst viktig å vite hvilke variabler som gjør at en kjemisk reaksjon kan gå så raskt som mulig. Noen ganger er imidlertid det motsatte ønsket: at reaksjonen skjer veldig sakte, spesielt hvis den er eksoterm og det er fare for eksplosjon.
Hva er disse variablene? Noen er fysiske, som ved hvilket trykk eller temperatur en reaktor eller et system skal ha; og andre er kjemiske, slik som typen løsningsmiddel, pH, saltholdighet, molekylær struktur, etc..
Før vi finner disse variablene, må vi imidlertid først studere kinetikken til den nåværende reaksjonen.
Hvordan? Gjennom variasjonen av konsentrasjon, som kan følges hvis en bestemt egenskap som er proporsjonal med den første blir kvantifisert. Gjennom historien har metoder blitt mer sofistikerte, noe som tillater mer nøyaktige og presise målinger, og med stadig kortere intervaller..
Reaksjonshastighet
For å bestemme hastigheten til en kjemisk reaksjon, er det nødvendig å vite hvordan konsentrasjonen varierer over tid for noen av de involverte artene. Denne hastigheten avhenger i stor grad av mange faktorer, men det viktigste er at den er målbar for de reaksjonene som foregår "sakte".
Her er ordet "sakte" relativt og er definert for alt som kan måles med de tilgjengelige instrumentelle teknikkene. Hvis for eksempel reaksjonen er mye raskere enn målekapasiteten til utstyret, vil den ikke være kvantitativ og heller ikke kinetikken til den kan studeres..
Deretter blir reaksjonshastigheten bestemt ved terskelen til en hvilken som helst prosess før den når likevekt. Hvorfor? Fordi i likevekt er hastigheten til fremoverreaksjonen (produktdannelse) og den omvendte reaksjonen (reaktantdannelse) den samme.
Ved å kontrollere variablene som virker på systemet, og følgelig dets kinetikk eller reaksjonshastigheten, kan de ideelle forholdene velges for å generere en viss mengde produkt på den mest ønskede og sikre tiden..
På den annen side avslører denne kunnskapen den molekylære mekanismen, som er verdifull når man øker utbyttet av en reaksjon..
Definisjon
Hastighet er endring av en størrelse som en funksjon av tid. For disse studiene ligger interessen i å bestemme variasjonen i konsentrasjonen etter hvert som timer og minutter går; nano, pico eller til og med femtosekunder (10-femtens).
Du kan ha mange enheter, men det enkleste og enkleste av alt er M s-1, eller hva er lik mol / L · s. Uavhengig av enhetene, bør den alltid ha en positiv verdi, siden det er en fysisk størrelse (for eksempel dimensjoner eller masse).
Imidlertid, etter konvensjon, har forsvinningsgraden for en reaktant et negativt tegn, og utseendet på et produkt har et positivt tegn..
Men hvis reaktantene og produktene har sine egne hastigheter, hvordan skal man da bestemme den totale reaksjonshastigheten? Svaret er i de støkiometriske koeffisientene.
Generell ligning
Følgende kjemiske ligning uttrykker reaksjonen av A og B for å danne C og D:
tilTIL + bB => cC + dD
Molare konsentrasjoner uttrykkes vanligvis i parentes, så for eksempel er konsentrasjonen av art A skrevet som [A]. Dermed er reaksjonshastigheten for hver av de involverte kjemiske artene:
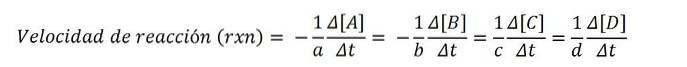
I henhold til den matematiske ligningen er det fire ruter for å nå reaksjonshastigheten: variasjonen i konsentrasjon av noen av reaktantene (A eller B) eller av produktene (C eller D) måles..
Del, med en av disse verdiene, og dens korrekte støkiometriske koeffisient, med den sistnevnte og for å oppnå reaksjonshastigheten rxn.
Siden reaksjonshastigheten er en positiv størrelse, multipliserer det negative tegnet de negative hastighetsverdiene til reaktantene; av denne grunn koeffisientene til Y b multipliser med (-1).
For eksempel hvis hastigheten på forsvinningen av A er - (5M / s), og dens støkiometriske koeffisient til er 2, så hastigheten rxn er lik 2,5M / s ((-1/2) x 5).
Desserteksempel

Hvis produktet var en dessert, ville ingrediensene analogt være reagensene; og den kjemiske ligningen, oppskriften:
7Cookies + 3 Brownies + 1 Ice Cream => 1 Dessert
Og hastighetene for hver av de søte ingrediensene og til selve desserten er:
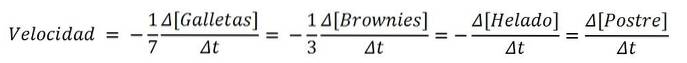
Dermed kan hastigheten med hvilken desserten blir bestemt bestemmes med variasjonen av enten kakene, brownies, isen eller selve settet; deretter dele den med dens støkiometriske koeffisienter (7, 3, 1 og 1). En av rutene kan imidlertid være enklere enn den andre..
Hvis du for eksempel måler hvordan [Dessert] stiger med forskjellige tidsintervaller, kan disse målingene være vanskelige..
På den annen side kan det være mer praktisk og praktisk å måle [Cookies] på grunn av antall eller noen av egenskapene som gjør konsentrasjonen lettere å bestemme enn brownies eller iskrem..
Hvordan bestemme det
Gitt den enkle reaksjonen A => B, hvis A, for eksempel i vandig oppløsning, har en grønn farge, avhenger dette av konsentrasjonen. Når A blir B, forsvinner den grønne fargen, og hvis denne forsvinningen kvantifiseres, kan en kurve på [A] vs t oppnås.
På den annen side, hvis B er en sur art, vil pH i løsningen synke til verdier under 7. Dermed, fra reduksjonen i pH oppnår vi [B], og påfølgende grafen [B] mot t. Når vi overlapper begge grafene, kan vi se noe som følger:

I grafen kan vi se hvordan [A] avtar med tiden, fordi den forbrukes, og hvordan kurven [B] øker med en positiv helling fordi det er produktet.
Det kan også sees at [A] har en tendens til null (hvis det ikke er noen likevekt) og at [B] når en maksimal verdi styrt av støkiometri, og hvis reaksjonen er fullført (alt A er forbrukt).
Reaksjonshastigheten til både A og B er tangentlinjen på en av disse kurvene; med andre ord derivatet.
Faktorer som påvirker reaksjonsfrekvens
Naturen til kjemiske arter
Hvis alle kjemiske reaksjoner var øyeblikkelige, ville deres kinetiske studier ikke eksistere. Mange har så høye hastigheter at de ikke kan måles; det vil si at de ikke er målbare.
Dermed er reaksjonene mellom ionene vanligvis veldig raske og komplette (med et utbytte på rundt 100%). På den annen side krever de som involverer organiske forbindelser litt tid. En reaksjon av den første typen er:
HtoSW4 + 2NaOH => NatoSW4 + 2HtoELLER
De sterke elektrostatiske interaksjonene mellom ionene favoriserer den raske dannelsen av vann og natriumsulfat. I stedet er en reaksjon av den andre typen for eksempel forestring av eddiksyre:
CH3COOH + CH3CHtoOH => CH3COOCHtoCH3 + HtoELLER
Selv om det også dannes vann, er reaksjonen ikke øyeblikkelig; selv under gunstige forhold tar det flere timer å fullføre.
Imidlertid har andre variabler mer innflytelse på reaksjonshastigheten: konsentrasjon av reaktanter, temperatur, trykk og tilstedeværelse av katalysatorer..
Reagenskonsentrasjon
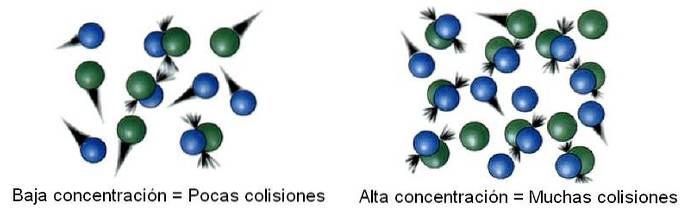
I kjemisk kinetikk kalles rommet som studeres, skilt fra uendelig, et system. For eksempel kan en reaktor, et begerglass, en kolbe, en sky, en stjerne, etc. betraktes som systemet som studeres..
Således er molekylene ikke statiske i systemet, men snarere "reiser" til alle hjørner. I noen av disse forskyvningene kolliderer det med et annet molekyl for å sprette tilbake eller produsere produkter..
Deretter er antall kollisjoner proporsjonalt med konsentrasjonen av reaktantene. Bildet over illustrerer hvordan systemet endres fra lave til høye konsentrasjoner.
Dessuten, jo flere kollisjoner det er, desto raskere blir reaksjonshastigheten, siden sjansene for at to molekyler reagerer øker..
Hvis reaktantene er gassformede, håndteres trykkvariabelen og er relatert til gasskonsentrasjonen forutsatt noen av de mange eksisterende ligningene (slik som den for den ideelle gassen); eller også reduseres systemets volum for å øke sjansene for at gassformige molekyler kolliderer.
Temperatur
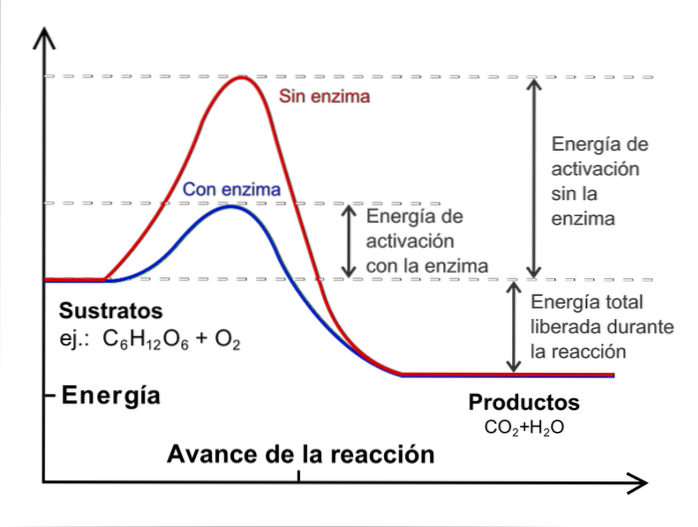
Selv om antall kollisjoner øker, har ikke alle molekyler den energien som kreves for å overskride aktiveringsenergien i prosessen.
Det er her temperaturen spiller en viktig rolle: den utfører funksjonen til å akselerere molekylene termisk slik at de kolliderer med mer energi..
Dermed fordobles reaksjonshastigheten generelt for hver 10 ° C økning i systemtemperaturen. For alle reaksjoner er dette imidlertid ikke alltid tilfelle. Hvordan forutsi denne økningen? Arrhenius-ligningen svarer på spørsmålet:
d (lnK) / dT = E / (RTto)
K er hastighetskonstanten ved temperaturen T, R er gasskonstanten og E er aktiveringsenergien. Denne energien er en indikasjon på energibarrieren som reaktantene må skaleres for å reagere..
For å gjennomføre en kinetisk studie er det nødvendig å holde temperaturen konstant og uten katalysatorer. Hva er katalysatorer? De er eksterne arter som griper inn i reaksjonen, men uten å bli konsumert, og som reduserer aktiveringsenergien.
Bildet over illustrerer begrepet katalyse for reaksjon av glukose med oksygen. Den røde linjen representerer aktiveringsenergien uten enzymet (biologisk katalysator), mens den blå linjen viser en reduksjon i aktiveringsenergien..
Reaksjonsrekkefølge i kjemisk kinetikk
I en kjemisk ligning er de støkiometriske indeksene, relatert til reaksjonsmekanismen, ikke like indeksene i samme orden. Kjemiske reaksjoner har vanligvis første eller andre orden, sjelden tredje orden..
For hva er dette? Fordi kollisjonene til tre energisk eksiterte molekyler er usannsynlige, og enda mer er firedoble eller femdobbelte kollisjoner, hvor sannsynligheten er uendelig liten. Fraksjonelle reaksjonsordrer er også mulig. For eksempel:
NH4Cl <=>NH3 + HCl
Reaksjonen er første orden i en forstand (fra venstre til høyre) og andre rekkefølge i den andre (fra høyre til venstre) hvis den anses å være en likevekt. Mens følgende likevekt er andre orden i begge retninger:
2HI <=> Hto + Jegto
Er molekularitet og reaksjonsrekkefølge den samme? Nei. Molekularitet er antall molekyler som reagerer for å gi produkter, og den totale reaksjonsrekkefølgen er den samme rekkefølgen av reaktantene som er involvert i trinnet for å bestemme hastigheten..
2KMnO4 + 10KI + 8HtoSW4 => 2MnSO4 + 5Ito + 6KtoSW4 + 8HtoELLER
Denne reaksjonen, til tross for at den har høye støkiometriske indekser (molekularitet), er faktisk en andre ordens reaksjon. Med andre ord er det avgjørende trinnet for hastigheten av andre orden.
Nullordensreaksjoner
De forekommer i tilfelle av heterogene reaksjoner. For eksempel: mellom en væske og et fast stoff. Dermed er hastigheten uavhengig av konsentrasjonene av reaktantene.
På samme måte, hvis en reaktant har en reaksjonsrekkefølge på null, betyr det at den ikke deltar i det avgjørende trinnet for hastigheten, men i den raske.
Første ordens reaksjon
A => B
En førsteordens reaksjon styres av følgende skattelov:
V = k [A]
Hvis konsentrasjonen av A dobler seg, dobler reaksjonshastigheten V. Derfor er hastigheten proporsjonal med konsentrasjonen av reagenset i det bestemte trinn av reaksjonen..
Andre ordens reaksjon
2A => B
A + B => C
To arter er involvert i denne typen reaksjoner, akkurat som i de to kjemiske ligningene som akkurat er skrevet. Prislovene for reaksjonene er:
V = k [A]to
V = k [A] [B]
I den første er reaksjonshastigheten proporsjonal med kvadratet av konsentrasjonen av A, mens i den andre forekommer det samme som i førsteordensreaksjonene: hastigheten er direkte proporsjonal med konsentrasjonene av både A og B.
Reaksjonsrekkefølge vs molekylæritet
I følge det forrige eksemplet kan de støkiometriske koeffisientene sammenfalle eller ikke falle sammen med reaksjonsrekkefølgen.
Dette skjer imidlertid for elementære reaksjoner, som bestemmer molekylærmekanismen til ethvert trinn i en reaksjon. I disse reaksjonene er koeffisientene lik antall deltakende molekyler.
For eksempel reagerer et molekyl A med et av B for å danne et molekyl av C. Her er molekylæren 1 for reaktantene, og deretter i uttrykket av hastighetsloven faller de sammen med reaksjonsordene.
Av dette følger det at molekylæriteten alltid må være et helt tall og sannsynlig mindre enn fire.
Hvorfor? Fordi i passasjen av en mekanisme er det svært lite sannsynlig at fire molekyler deltar samtidig; to av dem kunne reagere først, og deretter ville de resterende to reagere med dette produktet.
Matematisk er dette en av hovedforskjellene mellom reaksjonsordre og molekylæritet: en reaksjonsrekkefølge kan ta brøkverdier (1/2, 5/2, etc.).
Dette er fordi førstnevnte bare gjenspeiler hvordan konsentrasjonen av arten påvirker hastigheten, men ikke hvordan molekylene deres griper inn i prosessen..
applikasjoner
- Det gjør det mulig å bestemme tiden et legemiddel forblir i kroppen før den fullstendige metabolismen. På grunn av kinetiske studier kan enzymatisk katalyse følges som grønne metoder sammenlignet med andre katalysatorer med negativ miljøpåvirkning; eller også brukes i utallige industrielle prosesser.
- I bilindustrien, spesielt innen motorer, hvor elektrokjemiske reaksjoner må utføres raskt for at kjøretøyet skal starte. Også i eksosrørene, som har katalysatorer for å transformere de skadelige gassene CO, NO og NO.x i COto, HtoO, Nto megto i løpet av den optimale tiden.
2NaN3(s) = 2Na (s) + 3Nto(g)
-Det er reaksjonen bak hvorfor kollisjonsputer, 'kollisjonsputer', blåser opp når kjøretøyer kolliderer. Når dekkene smeller på bremsene, detonerer en detektor elektrisk natriumazidet, NaN3. Dette reagenset "eksploderer" og frigjør Nto, som opptar hele posens volum raskt.
Metallisk natrium reagerer deretter med andre komponenter for å nøytralisere det, fordi det i ren tilstand er giftig.
Referanser
- Walter J. Moore. (1963). Fysisk kjemi. I Kjemisk kinetikk. Fjerde utgave, Longmans.
- Ira N. Levine. (2009). Prinsipper for fysisk-kjemi. Sjette utgave, s. 479-540. Mc Graw Hill.
- UAwiki. (23. desember 2011). Molekylær-kollisjoner-er. [Figur]. Hentet 30. april 2018 fra: es.m.wikipedia.org
- Glasstone. (1970). Lærebok for fysisk kjemi. I Kjemisk kinetikk. Andre utgave. D. Van Nostrand, Company, Inc.
- Anne Marie Helmenstine, Ph.D. (8. mars 2017). Definisjon av kjemisk kinetikk. Hentet 30. april 2018 fra: thoughtco.com
- Khan Academy. (2018). Reaksjonsrate og rate lover. Hentet 30. april 2018 fra: khanacademy.org
- Germán Fernández. (26. juli 2010). Kjemisk kinetikk. Hentet 30. april 2018 fra: quimicafisica.com


Ingen har kommentert denne artikkelen ennå.