
Cytokrom c oksidasestruktur, funksjoner, hemmere
De cytokrom c oksidase Det er et kompleks av enzymatiske proteiner som kan krysse lipiddobbelaget i cellemembranen. Det er hemoløselig og er hovedsakelig assosiert med mitokondriens indre membran, som finnes i både prokaryote organismer (bakterier) og eukaryoter (encellede og flercellede)..
Dette enzymet kalles også kompleks IV, og er avgjørende for de aerobe metabolske funksjonene til organismer, da det er viktig i elektrontransportkjeden der cellen brenner sukker og fanger opp en del av energien som frigjøres for å lagre adenosintrifosfat eller ATP..
Navnet cytokrom betyr "cellulære pigmenter." Dette er blodproteiner som bærer elektroner. Cytokromer ble oppdaget av den irske legen Charles Alexander MacMunn i 1884. MacMunn var banebrytende for oppdagelsen av luftveisspigmentet i blodet, i dag kalt cytokrom 1..
På 1920-tallet gjenoppdaget og karakteriserte den russiske entomologen og parasitologen David Keilin luftpigmenter og var den som kalte dem cytokromer. Selv om MacMunn hadde oppdaget dem i 1884, hadde det vitenskapelige samfunnet glemt ham, og noen hadde til og med feiltolket arbeidet hans..
Artikkelindeks
- 1 Generelle egenskaper
- 1.1-Cytokrom c
- 2 Cytochrome c oxidase eller Complex IV
- 3 Struktur
- 4 funksjoner
- 4.1 Apoptose eller programmert celledød
- 4.2 Regenerering av celler eller vev
- 4.3 Energimetabolisme
- 5 Hemmere
- 6 Mangel
- 7 Bruk i fylogeni
- 8 Referanser
Generelle egenskaper
Generelt har respiratoriske pigmenter karakteristiske synlige lysspekter. Det er kjent at det er minst fire integrerte membranproteinkomplekser hvor det er 5 forskjellige typer cytokromer: a, a3, b, c1 og c, klassifisert i henhold til bølgelengdene til spektral absorpsjonsmaksima.
De finnes vanligvis på mitokondriens indre membran. Imidlertid har de også blitt observert i endoplasmatisk retikulum og kloroplaster, i eukaryote og prokaryote organismer..
De presenterer heme-protesegruppen som inneholder jern (Fe). Hver av de kjente cytokromene virker i multienzymkomplekser ved transport av elektroner i åndedrettsprosessen eller kjeden..
Cytokromer har den funksjonen at de deltar i oksidasjonsreduksjonsreaksjoner. Reduksjonsreaksjoner, der de aksepterer elektroner, forekommer forskjellig for hver type cytokrom, og verdien deres bestemmes av strømmen av elektroner fra luftveiskjeden.
-Cytokrom c
Fire klasser av cytokrom c er kjent, som er som følger.
Klasse I
Innenfor denne klassen er de oppløselige cytochromene c (lavspinn) med lav sentrifugering, tilstede i bakterier og mitokondrier. De er oktaedriske. Hem-bindingsstedet er ved N-terminalen av histidin, og den sjette liganden tilføres av en metioninrest ved C-terminalen..
Av denne klassen kan til og med gjenkjennes flere underklasser, hvis tredimensjonale struktur er bestemt..
Klasse II
Høyt spinn cytokrom c og noen lav spinn cytokrom c finnes i denne klassen. De høye svingene har bindingsstedet nær C-terminalen, og i de lave svingene ser den sjette liganden ut til å være en metioninrest nær N-terminalen. De er pentakoordinert med histidin fra den femte liganden.
Klasse III
Denne klassen er preget av å presentere cytokromer c med flere hem (c3 og c7) og et lavt oksydreduserende potensial, med bare 30 aminosyrerester per hemgruppe. I representanter for denne klassen har heme c-grupper ikke-ekvivalent struktur og funksjoner, i tillegg til å presentere forskjellige redoks-potensialer. De er oktaedriske.
Klasse IV
I følge noen forfattere ble denne klassen opprettet bare for å inkludere komplekse proteiner som andre protesegrupper presenterer, samt heme c, eller flavocytokrom c, blant andre..
Cytochrome c oxidase eller Complex IV
Cytochrome c oxidase er et mitokondrie enzym som utfører den siste fasen av elektrontransport i cellulær respirasjon. Dette enzymet katalyserer transporten av elektroner fra redusert cytokrom c til oksygen..
Noen kjemiske forbindelser som cyanid, karbondioksid og azid, kan hemme funksjonen til dette enzymet og forårsake såkalt cellulær kjemisk asfyksi. Andre former for inhibering av kompleks IV er genetiske mutasjoner.
Fra et evolusjonært synspunkt finnes cytokrom c oksidase bare i aerobe organismer, og flere grupper av forskere antyder at tilstedeværelsen av dette proteinet indikerer evolusjonære forhold der planter, sopp og også dyr delte en felles forfader.
Struktur
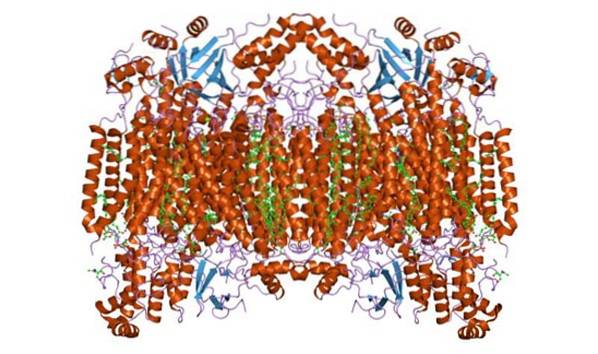
Cytokrom c oksidase danner et homodimert kompleks, det vil si sammensatt av to lignende monomerer i mitokondriens indre membran. Enzymkomplekset består av 3 til 4 underenheter i prokaryote organismer og opptil maksimalt 13 (noen antyder 14) polypeptider i organismer som pattedyr..
I disse organismer er 3 polypeptider av mitokondrie opprinnelse, og resten har sin opprinnelse i kjernen. Hver monomer har 28 transmembrane helixer som skiller hydrofile domener mot membranmatrisen og intermembranrommet..
Den har en enkelt katalytisk enhet, som finnes i alle enzymer som katalyserer oksidasjons- / reduksjonsreaksjoner, ved hjelp av molekylært oksygen (oksidaser, spesielt hem-kobber). Komplekset inneholder cytokromer a og a3 bundet av underenhet I og to kobbersentre.
Den har en eller flere heme C-grupper knyttet til den omkringliggende proteinstrukturen ved en eller flere (generelt to) tioeterbindinger. Andre forfattere antyder at det er en enkelt heme C-gruppe kovalent bundet til proteinet mellom porfyrinringen og to cysteinrester..
Den eneste heme c-gruppen nevnt ovenfor er omgitt av hydrofobe rester og er heksakoordinert, med histidin i posisjon 18 i polypeptidkjeden og metionin i posisjon 80..
Funksjoner
Cytokrom c oksidaser er hovedpersoner i tre hovedfysiologiske mekanismer, som vi vil se nedenfor.
Apoptose eller programmert celledød
Apoptose er programmert celledestruksjon eller død, forårsaket av selve organismen og hvis formål er å kontrollere vekst, utvikling, eliminering av skadet vev og regulering av immunsystemet. I denne fysiologiske prosessen deltar cytokrom c oksidase som et mellomprodukt.
Dette proteinet, frigjort av mitokondriene, fører til en interaksjon med det endoplasmatiske retikulum, som forårsaker utskillelse eller frigjøring av kalsium. Den progressive økningen i kalsium utløser en massiv frigjøring av cytokrom c oksidase, inntil det cytotoksiske nivået av kalsium er nådd..
Cytotoksisk kalsiumnivå og frigjøring av cytokromer c forårsaker kaskadeaktivering av flere caspase-enzymer, som er ansvarlige for ødeleggelsen av celler.
Regenerering av celle eller vev
Flere studier indikerer at når cytokrom c oksidase utsettes for bølgelengder på 670 nanometer, deltar den i et funksjonelt kompleks som trenger inn i skadet eller skadet vev og øker hastigheten på celleregenerering..
Energimetabolisme
Dette er kanskje den mest kjente og mest relevante funksjonen til cytokrom c oksidase. Det er nettopp oksidasekomplekset (i luftveiskjeden) som er ansvarlig for å samle elektronene fra cytokrom c og overføre dem til oksygenmolekylet, og redusere det til to vannmolekyler..
Koblet til denne prosessen skjer en protontranslokasjon gjennom membranen, noe som resulterer i generering av en elektrokjemisk gradient som ATP-syntetasekomplekset bruker for å produsere eller syntetisere ATP (adenosintrifosfat)..
Hemmere
Cytokrom c oksidase inhiberes av forskjellige kjemiske forbindelser og prosesser. Måten det oppstår på kan oppstå som en naturlig måte å regulere enzymets produksjon eller virkning på, eller det kan skje ved et uhell på grunn av forgiftning.
I nærvær av azid, cyanid eller karbonmonoksid binder cytokrom c oksidase til disse og funksjonen til proteinkomplekset hemmer. Dette forårsaker et avbrudd i den cellulære respirasjonsprosessen og forårsaker derfor den kjemiske kvelningen i cellene..
Andre forbindelser som nitrogenoksid, hydrogensulfid, metanol og noen metylerte alkoholer forårsaker også inhibering av cytokrom c oksidase..
Mangel
Cytochrome c oxidase er et enzym som styres av gener i både kjernen og mitokondriene. Det er genetiske endringer eller mutasjoner som kan føre til mangel på cytokrom c oksidase.
Disse mutasjonene forstyrrer enzymets funksjonalitet, siden de endrer dets enzymatiske struktur, og fører med seg metabolske forstyrrelser under embryonal utvikling (ifølge studier på mennesker), som senere vil påvirke organismen i de første leveårene..
Cytokrom c oksidasemangel påvirker vev med høyt energibehov, som hjerte, lever, hjerne og muskler. Symptomene på disse mutasjonene gjenspeiles før de to leveårene og kan manifestere seg som sterke eller milde forhold.
Mindre symptomer kan sees selv like etter det første år, og personer med dem har vanligvis bare nedsatt muskelspenning (hypotoni) og muskelatrofi (myopati)..
På den annen side kan personer med sterkere symptomer ha muskelatrofi og encefalomyopati. Andre forhold forårsaket av fravær av cytokrom c oksidase er hypertrofisk kardiomyopati, patologisk utvidelse av leveren, Leighs syndrom og melkesyreacidose..
Bruk i fylogeni
Fylogeni er vitenskapen som er ansvarlig for studiene av opprinnelse, dannelse og evolusjonær utvikling fra forfedres etterkommersyn, av organismer. I løpet av de siste tiårene har fylogenistudier med molekylær analyse vært oftere og hyppigere, noe som ga mye informasjon og løste taksonomiske problemer..
I denne forstand indikerer noen fylogenetiske studier at bruk av cytokrom c oksidaser kan bidra til å etablere evolusjonære forhold. Dette er fordi dette proteinkomplekset er svært konservert og er til stede i et bredt utvalg av organismer, alt fra encellede protister til store virveldyr..
Et eksempel på dette er testene laget med mennesker, sjimpanser (Paniscus brød) og Rhesus-makaker (Macaca mulatta). Slike tester viste at humane og sjimpanse cytokrom c oksidase molekyler var identiske..
Det viste også at cytokrom c oksidasemolekylene i Rhesus macaque skilte seg med en aminosyre fra de to første, og bekreftet følgelig forfedre-etterkommere forhold mellom sjimpanser og mennesker..
Referanser
- R.P. Ambler (1991). Sekvensvariabilitet i bakteriecytokromer c. Biochimica et Biophysica Acta (BBA) - Bioenergetikk.
- Cytokrom c. Gjenopprettet fra newworldencyclopedia.org.
- V. Colman, E. Costa, R. Chaves, V. Tórtora (2015). Biologiske roller for cytokrom c: mitokondrie elektrontransport, programmert celledød og gevinst i peroksidaktivitet. Annaler fra Det medisinske fakultet.
- Cytochrome c oxidase subunit I. Gjenopprettet fra ebi.ac.uk.
- L. Youfen, P. Jeong-Soon, D. Jian-Hong & B. Yidong (2007). Cytochrome c Oxidase Subunit IV er viktig for montering og respiratorisk funksjon av enzymkomplekset. Journal of Bioenergetics and Biomembranes.
- Gengruppe: Mitokondrie kompleks IV: cytokrom c oksidase underenheter (COX, MT-CO). Gjenopprettet fra genenames.org.
- E.F. Hartree (1973). Oppdagelsen av cytokrom. Biokjemisk utdanning.
- Cytokrom c oksidase, mangel på…. Gjenopprettet fra ivami.com.
- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Biokjemi. 3. utgave. Benjamin / Cummings Publishing Company, Inc.



Ingen har kommentert denne artikkelen ennå.