
Elektronisk kjernekonfigurasjonskonstruksjon, eksempler
De kjerneelektronkonfigurasjon eller kompakt er en hvis kvantennoteringer for antall elektroner og deres energinivåer forkortes med edelgassymbolene i parentes. Det er veldig nyttig når du skriver elektroniske konfigurasjoner for et bestemt element, da det er enkelt og raskt.
Ordet "kjerne" refererer vanligvis til de indre elektroniske skallene til et atom; det vil si de der elektronene deres ikke har valens og derfor ikke deltar i den kjemiske bindingen, selv om de definerer egenskapene til elementet. Metaforisk sett vil kjernen være det indre av løken, med lagene sammensatt av en serie orbitaler som øker i energi.
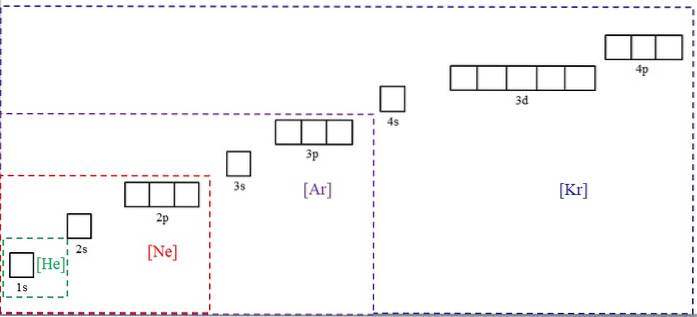
Bildet over viser kjemiske symboler for fire av edelgassene i parentes og med forskjellige farger: [He] (grønn), [Ne] (rød), [Ar] (lilla) og [Kr] (blå).
Hver av de prikkede rammene inneholder bokser som representerer orbitalene. Jo større de er, jo større antall elektroner inneholder de; som igjen vil bety at de elektroniske konfigurasjonene av flere elementer kan forenkles med disse symbolene. Dette sparer tid og energi ved å skrive alle notasjonene.
Artikkelindeks
- 1 Bygg ordre
- 2 Forkortelse for elektronkonfigurasjon
- 3 eksempler
- 3.1 Generelt
- 3.2 Oksygen
- 3.3 Kalium
- 3.4 Indisk
- 3.5 Wolfram
- 4 Referanser
Bygg ordre
Før du bruker elektroniske kjernekonfigurasjoner, er det lurt å gjennomgå riktig rekkefølge for å bygge eller skrive disse konfigurasjonene. Dette styres i henhold til diagonalregelen eller Moeller-diagrammet (kalt i noen deler regnmetoden). Å ha dette diagrammet for hånden, er kvantebetegnelsene som følger:
1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d 7p
Denne strengen med kvantebeskrivelser ser anstrengende ut og det ville være enda mer hvis det måtte skrives hver gang elektronkonfigurasjonen til et element funnet i periode 5 og fremover skulle bli representert. Vær også oppmerksom på at strengen er tom for elektroner; det er ingen tall i øvre høyre vinkel (1sto2sto2 s6...).
Det må huskes at orbitalene s kan "huse" to elektroner (nsto). Orbitaler s det er tre totalt (se på de tre boksene ovenfor), slik at de har plass til seks elektroner (np6). Og til slutt, orbitalene d det er fem, og F syv, med totalt ti (nd10) og fjorten (nf14) elektroner, henholdsvis.
Forkortelse for elektronkonfigurasjon
Når det er sagt ovenfor, fortsetter vi med å fylle den forrige raden med kvantebetegnelser med elektroner:
1sto 2sto 2 s6 3sto 3p6 4sto 3d10 4p6 5sto 4d10 5 s6 6sto 4f14 5 d10 6p6 7sto 5f14 6d10 7p6
Hvor mange elektroner er det i alt? 118. Og til hvilket element tilsvarer et så stort antall elektroner i dets atom? Til edelgass oganeson, Og.
Anta at det er et element med et kvantetall Z lik 119. Da ville valenselektronkonfigurasjonen være 8s1; men hva ville den komplette elektroniske konfigurasjonen være?
1sto 2sto 2 s6 3sto 3p6 4sto 3d10 4p6 5sto 4d10 5 s6 6sto 4f14 5 d10 6p6 7sto 5f14 6d10 7p6 8s1
Og hva ville din elektroniske kjernekonfigurasjon være, den kompakte? Er:
[Og] 8s1
Legg merke til den åpenbare forenklingen eller forkortelsen. I symbolet [Og] telles alle 118 elektronene som er skrevet ovenfor, så dette usikre elementet har 119 elektroner, hvorav bare en har valens (det vil være plassert under francium i det periodiske systemet).
Eksempler
generell
Anta at nå vil du gjøre forkortelsen gradvis:
[Han] 2sto 2 s6 3sto 3p6 4sto 3d10 4p6 5sto 4d10 5 s6 6sto 4f14 5 d10 6p6 7sto 5f14 6d10 7p6
Merk at 1sto den ble erstattet av [Han]. Den neste edelgassen er neon, som har 10 elektroner. Å vite dette, fortsetter forkortelsen:
[Ne] 3sto 3p6 4sto 3d10 4p6 5sto 4d10 5 s6 6sto 4f14 5 d10 6p6 7sto 5f14 6d10 7p6
Deretter følger argon med 18 elektroner:
[Ar] 4sto 3d10 4p6 5sto 4d10 5 s6 6sto 4f14 5 d10 6p6 7sto 5f14 6d10 7p6
Fordi neste edelgass er krypton, forkortes forkortelsen med ytterligere 36 elektroner:
[Kr] 5sto 4d10 5 s6 6sto 4f14 5 d10 6p6 7sto 5f14 6d10 7p6
Xenon har 54 elektroner, og derfor flytter vi forkortelsen til 5p-orbitalen:
[Xe] 6sto 4f14 5 d10 6p6 7sto 5f14 6d10 7p6
Nå vil du ha lagt merke til at elektronkonfigurasjonen alltid er forkortet til np orbital; edelgassene har disse orbitalene fylt med elektroner. Og til slutt følger radon med 86 elektroner, så vi forkorter til 6p-orbitalen:
[Rn] 7sto 5f14 6d10 7p6
Oksygen
Oksygen har åtte elektroner, og den komplette elektroniske konfigurasjonen er:
1sto2sto2 s4
Den eneste forkortelsen vi kan bruke er [He] i 1sto. Dermed blir din elektroniske kjernekonfigurasjon:
[Han] 2sto2 s4
Kalium
Kalium har nitten elektroner, og den komplette elektroniske konfigurasjonen er:
1sto 2sto 2 s6 3sto 3p6 4s1
Merk at vi kan bruke symbolet [He] for å forkorte denne konfigurasjonen; samt [Ne] og [Ar]. Sistnevnte er den som brukes fordi argon er edelgassen som kommer nærmest kalium. Så kjerneelektronkonfigurasjonen din ser ut som:
[Ar] 4s1
Indisk
Indium har førti-ni elektroner, og den komplette elektroniske konfigurasjonen er:
1sto 2sto 2 s6 3sto 3p6 4sto 3d10 4p6 5sto 4d10 5 s1
Siden krypton er den nærmeste edelgassen som går foran indium, brukes symbolet [Kr] for forkortelsen, og vi har kjerneelektronkonfigurasjonen:
[Kr] 5sto 4d10 5 s1
Selv om 4d-orbitalene ikke formelt hører til indiumkjernen, er deres elektroner ikke involvert (i det minste under normale forhold) i dens metallbinding, men snarere de fra 5s og 5p-orbitalene..
Wolfram
Wolfram (eller wolfram) har 74 elektroner, og den komplette elektronkonfigurasjonen er:
1sto 2sto 2 s6 3sto 3p6 4sto 3d10 4p6 5sto 4d10 5 s6 6sto 4f14 5 d4
Igjen ser vi etter den nærmeste edelgassen som går foran den. I ditt tilfelle tilsvarer det xenon, som har sine fulle 5p-orbitaler. Så vi erstatter strengen med kvantebeskrivelser med symbolet [Xe], og vi vil endelig få sin kjerneelektronkonfigurasjon:
[Xe] 6sto 4f14 5 d4
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Pat Thayer. (2016). Elektronkonfigurasjonsdiagrammer. Gjenopprettet fra: chemistryapp.org
- Helmenstine, Anne Marie, Ph.D. (5. desember 2018). Definisjon av edelgasskjerne. Gjenopprettet fra: thoughtco.com/
- Wikipedia. (2019). Elektronisk konfigurasjon. Gjenopprettet fra: es.wikipedia.org



Ingen har kommentert denne artikkelen ennå.