
Moeller-diagram over hva det består og øvelser løst
De Moeller-diagram o Rain-metoden er en grafisk og mnemonisk metode for å lære Madelungs regel; det vil si hvordan man skriver elektronkonfigurasjonen til et element. Den er preget av å tegne diagonaler gjennom orbitalens kolonner, og etter pilens retning etableres riktig rekkefølge av det samme for et atom.
I noen deler av verden er Moeller-diagrammet også kjent som regnmetode. Gjennom dette defineres en orden i fyllingen av orbitalene, som også er definert av de tre kvantetallene n, l Y ml.
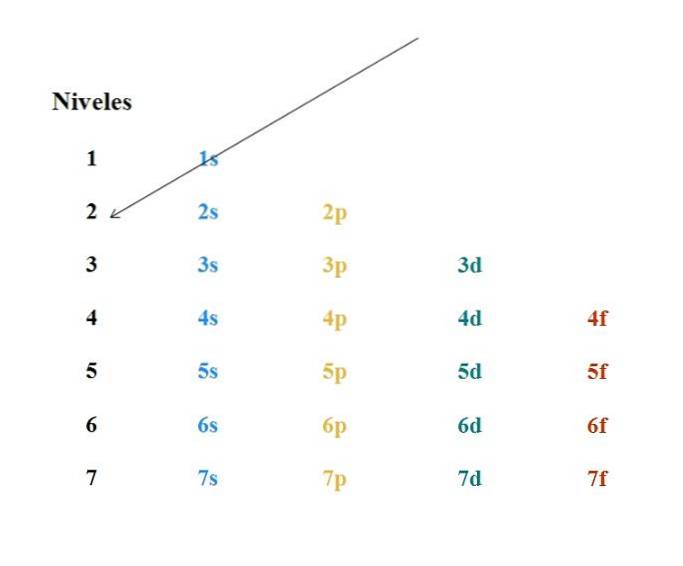
Et enkelt Moeller-diagram er vist på bildet over. Hver kolonne tilsvarer forskjellige orbitaler: s, p, d og f, med sine respektive energinivåer. Den første pilen indikerer at fyllingen av et hvilket som helst atom må begynne med 1s-bane.
Dermed må neste pil starte fra 2s orbital, og deretter fra 2p gjennom 3s orbital. På denne måten, som om det var et regn, orbitalene og antall elektroner de inneholder (4l+to).
Moeller-diagrammet representerer en introduksjon for de som studerer elektronkonfigurasjoner..
Artikkelindeks
- 1 Hva er Moeller-diagrammet?
- 1.1 Madelungs styre
- 1.2 Fremgangsmåte å følge
- 2 Løst øvelser
- 2.1 Beryllium
- 2.2 Fosfor
- 2.3 Zirkonium
- 2.4 Iridium
- 2.5 Unntak fra Moeller-diagrammet og Madelungs regel
- 3 Referanser
Hva er Moeller-diagrammet?
Madelungs styre
Siden Moeller-diagrammet består av en grafisk fremstilling av Madelungs regel, er det nødvendig å vite hvordan sistnevnte fungerer. Fyllingen av orbitalene må overholde følgende to regler:
-Orbitalene med de laveste verdiene på n+l blir fylt først, blir n hovedkvantetallet, og l det banevinkelmomentet. For eksempel tilsvarer 3d-bane n= 3 og l= 2, derfor, n+l= 3 + 2 = 5; i mellomtiden tilsvarer 4s orbital n= 4 og l= 0, og n+l= 4 + 0 = 4. Fra ovenstående er det fastslått at elektronene fyller 4s-bane først enn 3d-en.
-Hvis to orbitaler har samme verdi på n+l, elektronene vil først okkupere den med den laveste verdien av n. For eksempel har 3d-banen en verdi på n+l= 5, som 4p orbital (4 + 1 = 5); men siden 3d har den minste verdien av n, vil fylle opp tidligere enn 4p.
Fra de to foregående observasjonene kan følgende rekkefølge for fylling av orbitalene nås: 1s 2s 2p 3s 3p 4s 3d 4p.
Ved å følge de samme trinnene for forskjellige verdier av n+l for hver bane oppnås elektroniske konfigurasjoner av andre atomer; som igjen også kan bestemmes av Moeller-diagrammet grafisk.
Fremgangsmåte å følge
Madelungs regel sier formelen n+l, som den elektroniske konfigurasjonen kan "tilkobles" med. Som nevnt representerer Moeller-diagrammet imidlertid dette grafisk; så bare følg kolonnene og tegne diagonaler trinn for trinn.
Hvordan starter du den elektroniske konfigurasjonen av et atom? For å gjøre dette, må du først vite atomnummeret Z, som per definisjon for et nøytralt atom er lik antall elektroner.
Dermed oppnås antall elektroner med Z, og med dette i bakhodet begynner vi å tegne diagonaler gjennom Moeller-diagrammet..
Orbitalene har plass til to elektroner (bruker formel 4l+2), p seks elektroner, d ti og f fjorten. Den stopper ved bane der det siste elektronet som ble gitt av Z har blitt okkupert.
For nærmere avklaring, nedenfor er det en serie løste øvelser.
Løst øvelser
Beryllium
Ved hjelp av det periodiske systemet ligger elementet beryllium med Z = 4; det vil si at de fire elektronene må få plass i orbitalene.
Fra og med den første pilen i Moeller-diagrammet opptar 1s-orbitalen to elektroner: 1sto; etterfulgt av 2s orbital, med to ekstra elektroner for å legge til totalt 4: 2sto.
Derfor er elektronkonfigurasjonen av beryllium, uttrykt som [Be] 1sto2sto. Merk at summeringen av overskriftene er lik antall elektroner.
Kamp
Elementet fosfor har en Z = 15, og derfor har den totalt 15 elektroner som må oppta orbitalene. For å komme videre, begynner du med en gang med 1s-innstillingento2sto, som inneholder 4 elektroner. Da mangler det 9 elektroner til.
Etter 2s-orbitalen "kommer" neste pil gjennom 2p-orbitalen, til slutt lander i 3s-orbitalen. Siden 2p-orbitalene kan okkupere 6 elektroner, og 3s 2-elektroner, har vi: 1sto2sto2 s63sto.
Det mangler fortsatt 3 elektroner til, som opptar følgende 3p-bane i henhold til Moeller-diagrammet: 1sto2sto2 s63sto3p3, elektronkonfigurasjon av fosfor [P].
Zirkonium
Elementet zirkonium har en Z = 40. Forkortingsbane med 1s oppsettto2sto2 s63sto3p6, med 18 elektroner (det fra edelgassargonet), så ville 22 flere elektroner mangle. Etter 3p-bane er den neste som fylles i henhold til Moeller-diagrammet 4s, 3d, 4p og 5s orbitaler.
Å fylle dem helt, det vil si 4sto, 3d10, 4p6 og 5sto, totalt tilføres 20 elektroner. De to gjenværende elektronene er derfor plassert i følgende bane: 4d. Dermed er elektronkonfigurasjonen av zirkonium, [Zr]: 1sto2sto2 s63sto3p64sto3d104p65sto4dto.
Iridium
Iridium har en Z = 77, så den har 37 ekstra elektroner sammenlignet med zirkonium. Starter fra [Cd], det vil si 1sto2sto2 s63sto3p64sto3d104p65sto4d10, legg til 29 elektroner med følgende orbitaler i Moeller-diagrammet.
Tegning av nye diagonaler, de nye orbitalene er: 5p, 6s, 4f og 5d. Å fylle de tre første orbitalene helt, har vi: 5p6, 6sto og 4f14, å gi totalt 22 elektroner.
Så 7 elektroner mangler, som er i 5d: 1s orbital.to2sto2 s63sto3p64sto3d104p65sto4d105 s66sto4f145 d7.
Ovennevnte er elektronkonfigurasjonen av iridium, [Go]. Merk at 6-tallet orbitalerto og 5d7 er markert med fet skrift for å indikere at de samsvarer riktig med valenslaget til dette metallet.
Unntak fra Moeller-diagrammet og Madelungs regel
Det er mange elementer i det periodiske systemet som ikke adlyder det som nettopp er forklart. Elektronkonfigurasjonene deres skiller seg eksperimentelt fra de som er forutsagt av kvanteårsaker..
Blant elementene som presenterer disse avvikene er: krom (Z = 24), kobber (Z = 29), sølv (Z = 47), rodium (Z = 45), cerium (Z = 58), niob (Z = 41) og mange flere.
Unntak er svært hyppige i fyllingen av d- og f-orbitalene. For eksempel bør krom ha en valensinnstilling på 4sto3d4 i følge Moellers diagram og Madelungs regel, men det er faktisk 4s13d5.
Også, og til slutt bør sølvvalensinnstillingen være 5sto4d9; men det er virkelig 5s14d10.
Referanser
- Gavira J. Vallejo M. (6. august 2013). Unntak fra Madelungs regel og Mellers diagram i den elektroniske konfigurasjonen av kjemiske elementer. Gjenopprettet fra: triplenlace.com
- Min superklasse. (s.f.) Hva er elektronkonfigurasjon? Gjenopprettet fra: misuperclase.com
- Wikipedia. (2018). Moeller-diagram. Gjenopprettet fra: es.wikipedia.org
- Dumminger. (2018). Hvordan representere elektroner i et energinivådiagram. Gjenopprettet fra: dummies.com
- Nave R. (2016). Bestilling av fylling av elektronstater. Gjenopprettet fra: hyperphysics.phy-astr.gsu.edu


Ingen har kommentert denne artikkelen ennå.