
Diklormetanstruktur, egenskaper, bruksområder, toksisitet
De diklormetan, også kjent som metylenklorid, det er en organisk forbindelse hvis kjemiske formel er CHtoClto. Spesielt er det et alkylhalogenid avledet fra metangass. I motsetning til metan er denne forbindelsen en fargeløs, polær væske.
Den ble opprinnelig syntetisert i 1839 av den franske kjemikeren og fysikeren Henri Victor Regnault (1810-1878), som klarte å isolere den fra en blanding av klor og klormetan utsatt for sollys..

Diklormetan produseres industrielt ved å behandle metan eller klormetan med klorgass ved forhøyede temperaturer (400-500 ºC). Sammen med diklormetan produseres kloroform og karbontetraklorid i prosessen, som skilles fra destillasjon..
Diklormetan brukes som løsningsmiddel som tillater sveising av plastmaterialer og avfetting av metaller. Det brukes også til koffeinfri kaffe og te, samt humleekstrakter og fortynningsmiddel for tilsetningsstoffer i farger og blekk for merking av frukt..
Diklormetan er en giftig forbindelse som kan forårsake irritasjon i nesegangene og halsen ved innånding. Leverskader er rapportert hos arbeidstakere som er utsatt for høye konsentrasjoner av diklormetan. I tillegg er det et mutagent middel som mistenkes for å være kreftfremkallende.
Artikkelindeks
- 1 Struktur
- 2 eiendommer
- 2.1 Utseende
- 2.2 Molarmasse
- 2.3 Lukt
- 2.4 Luktterskel
- 2,5 Tetthet
- 2.6 Smeltepunkt
- 2.7 Kokepunkt
- 2.8 Løselighet i vann
- 2.9 Løselighet i andre løsningsmidler
- 2.10 Fordelingskoeffisient for oktanol / vann
- 2.11 Damptrykk
- 2.12 Damptetthet
- 2.13 Brytningsindeks (πD)
- 2.14 Viskositet
- 2.15 Flammepunkt
- 2.16 Selvantennelsestemperatur
- 2.17 Stabilitet
- 2.18 Nedbrytning
- 2.19 Korrosjon
- 2.20 Fordampningsvarme
- 2.21 Overflatespenning
- 2.22 Reaktivitet
- 3 bruksområder
- 3.1 Matbehandling
- 3.2 Farmasøytisk industri
- 3.3 Fotografering
- 3.4 Elektronikkindustrien
- 3.5 Malerier
- 3.6 Transport
- 3.7 Andre bruksområder
- 4 Toksisitet
- 4.1 Akutte effekter
- 4.2 Kroniske effekter
- 5 Referanser
Struktur
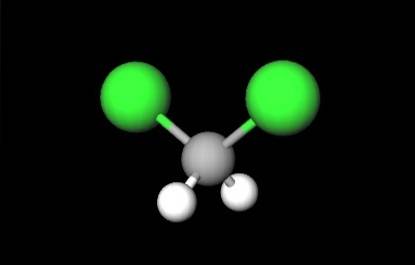
Det første bildet viste strukturformelen til CHtoClto, hvor deres kovalente bindinger C-H og C-Cl skiller seg ut. Over har også strukturen representert av en modell av kuler og stenger. Legg merke til med det blotte øye at C-H-bindingene (hvite kuler) er korte, mens C-Cl-bindingene (grønne kuler) er lange.
Geometrien til CHtoClto det er tetraeder; men forvrengt av de større kloratomer. Den ene enden av tetraedret er definert av de to kloratomene, mer elektronegative enn de av hydrogen og karbon. Derfor i CH-molekylettoClto et permanent dipolmoment er etablert (1.6D).
Dette gjør at diklormetanmolekylene kan samhandle med hverandre gjennom dipol-dipolkrefter. Likeledes er disse intermolekylære interaksjonene ansvarlige for det faktum at denne forbindelsen eksisterer som en væske til tross for dens lave molekylvekt; en væske som imidlertid er ganske flyktig.
Eiendommer
Utseende
Fargeløs væske.
Molarmasse
84,93 g / mol.
Lukt
Søt, ligner på kloroform.
Luktterskel
205 - 307 spm.
Tetthet
1,3266 g / cm3 (20 ºC).
Smeltepunkt
- 97,6 ºC.
Kokepunkt
39,6 ºC.
Vannløselighet
25,6 g / L ved 15 ° C og 5,2 g / L ved 60 ° C.
Diklormetan er knapt oppløselig i vann. Mens begge molekylene, CHtoClto og HtoEller, de er polære, deres interaksjoner er ineffektive, muligens på grunn av frastøting mellom klor- og oksygenatomer.
Løselighet i andre løsningsmidler
Blandbar med etylacetat, alkohol, heksan, benzen, karbontetraklorid, dietyleter, kloroform og dimetylformamid.
Fordelingskoeffisient for oktanol / vann
Logg P = 1,19.
Damptrykk
57,3 kPa (25 ° C). Dette trykket tilsvarer omtrent 5,66 atm, noe som gjenspeiler et høyt damptrykk..
Damptetthet
2.93 i forhold til luft tatt som 1.
Brytningsindeks (πD)
1.4244 (20 ºC).
Viskositet
0,413 cP (25 ° C).
antennelsespunkt
Diklormetan er ikke brannfarlig, men når det blandes med luft danner det brennbare damper over 100 ° C..
Selvantennelsestemperatur
556 ºC.
Stabilitet
Den er stabil ved omgivelsestemperatur i fravær av fuktighet, og har en relativ stabilitet sammenlignet med dens kongenere: kloroform og karbontetraklorid..
Den har en tendens til å forkulles ved høye temperaturer (300-450 ºC), når dampene kommer i kontakt med stål og metallklorider.
Nedbrytning
Kan spaltes ved kontakt med varme overflater eller flamme, og avgir giftige og irriterende røyk fra fosgen og hydrogenklorid..
Korrosjon
Diklormetan angriper noen former for plast, gummi og belegg.
Fordampningsvarme
28,82 kJ / mol ved 25 ºC.
Overflatespenning
28,20 dyn / cm ved 25 ºC.
Reaktivitet
Diklormetan reagerer sterkt med aktive metaller, som kalium, natrium og litium. Reagerer med sterke baser, f.eks. Kalium-tert-butoxide. Det er uforenlig med etsende stoffer, oksidanter og kjemisk aktive metaller.
I tillegg reagerer det med flytende oksygen i natrium- og kaliumlegeringer og nitrogentetroksid. I kontakt med vann kan det korrodere rustfritt stål, nikkel, kobber, så vel som jern.
applikasjoner
De fleste bruksområder og anvendelser av diklormetan er basert på egenskapene som løsningsmiddel. På grunn av denne egenskapen brukes diklormetan i næringsmiddelindustrien, transport, medisinproduksjon, etc..
Matforedling
Diklormetan brukes til koffeinfrihet av kaffebønner og teblader. Den brukes også til utvinning av humle til øl, drikkevarer og andre smaksstoffer til mat, samt til bearbeiding av krydder..
Legemiddelindustrien
Diklormetan brukes til fremstilling av cefalosporin og ampicillin, i tillegg til fremstilling av antibiotika, steroider og vitaminer.
Fotografering
Det brukes også som løsningsmiddel i produksjonen av cellulosetriacetat (CTA), brukt til å lage sikkerhetsfilmer.
Elektronisk industri
Det er en ideell forbindelse for produksjon av kretskort, som brukes til å avfette aluminiumsoverflaten før du tilfører fotoresistlaget på kortet..
Maling
Diklormetan er et løsemiddel som finnes i lakk og malingsskillere, og brukes til å fjerne lakk eller maling fra forskjellige typer overflater..
Transportere
Den brukes til å avfette metalldeler og overflater som finnes i jernbaneutstyr, så vel som i flykomponenter.
Andre bruksområder
Det brukes som spraydrivmiddel (aerosoler) og som et blåsemiddel for polyuretanskum. Det brukes også som væske i noen typer julelys.
Toksisitet
Akutte effekter
Innånding av diklormetan kan forårsake irritasjon i øvre luftveier, hoste, tungpustethet eller kortpustethet..
Det kan forårsake rødhet i huden, og hvis forbindelsen forblir på den i lang tid, kan det føre til kjemiske forbrenninger. Ved kontakt med øynene produserer diklormetan en alvorlig irritasjon som kan utvide seg til en forbrenning.
I tillegg fungerer det som et nevrotoksin som genererer syns-, hørsels- og psykomotoriske forstyrrelser; men disse effektene er reversible når innåndingen av diklormetan stoppes.
Kroniske effekter
Diklormetan kan påvirke sentralnervesystemet, forårsake hodepine, mental forvirring, kvalme, oppkast og hukommelsestap..
Hos dyr gir det skadelige effekter på leveren, nyrene, sentralnervesystemet og det kardiovaskulære systemet.
Når det gjelder karsinogenese, er det ikke rapportert om noen signifikant økning i kreftdødsfall hos arbeidstakere utsatt for diklormetan. Imidlertid har studier på dyr vist en økning som kan tilskrives diklormetan i forekomsten av lever- og lungekreft, samt godartede svulster i brystkjertlene..
Referanser
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kjemi. 5ta Utgave. Redaksjonell Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. (10th utgave.). Wiley pluss.
- Nasjonalt senter for bioteknologisk informasjon. (2020). Diklormetan. PubChem Database., CID = 6344. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2020). Diklormetan. Gjenopprettet fra: en.wikipedia.org
- Brumer. (14. juli 2018). Diklormetan. Gjenopprettet fra: brumer.com
- MSDS Online. (2019). Diklormetan (metylenklorid) Fare- og sikkerhetsinformasjon. Gjenopprettet fra: msdsonline.com
- EPA. (2000). Metylenklorid (diklormetan). [PDF]. Gjenopprettet fra: epa.gov



Ingen har kommentert denne artikkelen ennå.