
Dihydroxyacetone phosphate (DHAP) egenskaper og anvendelser
De dihydroksyacetonfosfat Det er en kjemisk forbindelse forkortet under akronymet DHAP. Det er et mellomledd i noen metabolske veier for levende organismer, som glykolytisk nedbrytning eller glykolyse, så vel som i Calvin-syklusen i planter.
Biokjemisk er DHAP produktet av virkningen av et aldolaseenzym på fruktose-1,6-bisfosfat (FBP), som forårsaker aldolytisk nedbrytning som resulterer i to tre-karbonforbindelser: DHAP og glyceraldehyd 3-fosfat (GAP).
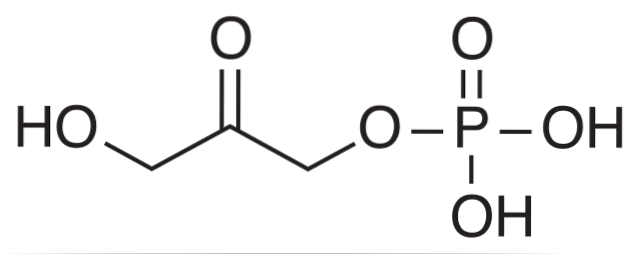
I Calvin-syklusen utfører aldolase den omvendte reaksjonen og kondenserer DHAP-molekyler med GAP-molekyler for å danne en heksose..
Artikkelindeks
- 1 Funksjoner
- 2 DHAP i glykolyse
- 2.1 Aldolasereaksjon
- 2.2 Reaksjon av TIM
- 3 DHAP i Calvin-syklusen
- 4 DHAP i glukoneogenese
- 5 Referanser
Kjennetegn
DHAP er klassifisert i molekylene kjent som ketotrioses. Dette er monosakkarider som består av en kjede av tre karbon (trioser) med karbonylgruppen på det sentrale karbonet (C2).
GAP og DAHP er funksjonelle isomerer og utgjør de enkleste karbohydratene innen biologisk aktive organiske molekyler.
Selv om den kjemiske strukturen til mange vanlige karbohydrater som GAP og DHAP er aldehyder og ketoner, får de begrepet karbohydrat, og refererer til direkte derivater av sakkarider..
DHAP i glykolyse
I glykolyse nedbryter en rekke reaksjoner glukose til pyruvat. Denne nedbrytningen skjer gradvis i ti påfølgende trinn, hvor forskjellige enzymer griper inn og det produseres en rekke mellomprodukter, som alle er fosforylerte..
DHAP vises i glykolyse i den fjerde reaksjonen av denne prosessen, som består av nedbrytningen av FBP i to karbohydrater av tre karbonatomer (trioser), hvorav bare GAP fortsetter glykolysesekvensen, mens DHAP trenger å bli transformert til GAP for å følge denne ruten.
Denne reaksjonen katalyseres av en aldolase (fruktose bisfosfat aldolase), som utfører en aldol spalting mellom C3 og C4 karbonene i FBP.
Denne reaksjonen skjer bare hvis heksosen som skal deles, har en karbonylgruppe ved C2 og en hydroksyl ved C4. Av denne grunn forekommer isomerisering av glukose-6-fosfat (G6P) til fruktose 6-fosfat (F6P) tidligere..
DHAP er også involvert i den femte glykolysereaksjonen, det vil si dens isomerisering til GAP av enzymet triose phosphate isomerase eller TIM. Med denne reaksjonen er den første fasen av glukose nedbrytning fullført..
Aldolase-reaksjon
I aldol-nedbrytningen produseres to mellomprodukter, hvor DHAP utgjør 90% av blandingen i likevekt.
Det er to typer aldolaser: a) type I aldolase er til stede i dyre- og planteceller og er preget av dannelsen av en Schiff-base mellom det enzymatiske aktive stedet og karbonylen i FBP. b) Type II aldolase finnes i noen bakterier og sopp, den har et metall i det aktive stedet (vanligvis Zn).
Aldolspaltingen begynner med vedheft av substratet til det aktive stedet og fjerning av en proton fra β-hydroksylgruppen, og danner den protonerte Schiff-basen (iminiumkation). Nedbrytningen av C3 og C4 karbon produserer frigjøring av GAP og dannelse av et mellomprodukt kalt enamin..
Enaminen stabiliseres deretter, så det dannes en iminiumkation som hydrolyseres, med hvilken DHAP endelig frigjøres og det frie enzymet regenereres.
I celler med aldolase type II forekommer ikke dannelsen av Schiff-basen, et divalent metallisk kation, generelt Znto+, den som stabiliserer det mellomliggende enaminen for å frigjøre DHAP.
TIM-reaksjon
Som nevnt er likevektskonsentrasjonen av DHAP høyere enn for GAP, slik at DHAP-molekyler blir transformert til GAP, da sistnevnte blir brukt i den følgende glykolysereaksjonen..
Denne transformasjonen skjer takket være TIM-enzymet. Dette er den femte reaksjonen av den glykolytiske nedbrytingsprosessen, og i den blir C1- og C6-karbonene av glukose C3-karbonene i GAP, mens C2- og C5-karbonene blir C2 og C3 og C4 av glukose, de blir C1 av GAP.
TIM-enzymet regnes som det "perfekte enzymet" fordi diffusjon styrer reaksjonshastigheten, noe som betyr at produktet dannes like raskt som enzymets aktive sted og dets substrat kommer sammen..
I reaksjonen av transformasjon av DHAP til GAP dannes et mellomprodukt kalt enediol. Denne forbindelsen er i stand til å gi fra seg protonene til hydroksylgruppene til en rest av det aktive stedet for TIM-enzymet..
DHAP i Calvin-syklusen
Calvin-syklusen er den fotosyntetiske karbonreduksjonssyklusen (PCR) som utgjør den mørke fasen av fotosynteseprosessen i planter. I dette stadiet brukes produktene (ATP og NADPH) oppnådd i den lette fasen av prosessen til å lage karbohydrater..
I denne syklusen dannes seks GAP-molekyler, hvorav to transformeres til DHAP ved isomerisering, takket være virkningen av TIM-enzymet, i en omvendt reaksjon på det som skjer i nedbrytningen av glykolyse. Denne reaksjonen er reversibel, selv om likevekten i tilfelle av denne syklusen, og i motsetning til glykolyse, er forskjøvet mot konvertering av GAP til DHAP.
Disse DHAP-molekylene kan deretter følge to veier, den ene er en aldolkondensasjon katalysert av en aldolase, der den kondenserer med et GAP-molekyl for å danne FBP.
Den andre reaksjonen som en av DHAP-ene kan ta er en fosfathydrolyse katalysert av en sedoheptulose-bisfosfatase. I denne siste ruten reagerer den med en erytrose og danner sedoheptulose 1,7-bisfosfat.
DHAP i glukoneogenese
I glukoneogenese blir noen ikke-glukidforbindelser som pyruvat, laktat og noen aminosyrer omdannet til glukose. I denne prosessen vises DHAP igjen gjennom isomerisering av et GAP-molekyl ved TIM-virkning, og deretter gjennom en aldolkondensasjon blir det FBP.
Referanser
- Bailey, P. S., og Bailey, C. A. (1998). Organisk kjemi: konsepter og anvendelser. Ed. Pearson Education.
- Devlin, T. M. (1992). Lærebok for biokjemi: med kliniske sammenhenger. John Wiley & Sons, Inc..
- Garrett, R. H., & Grisham, C. M. (2008). Biokjemi. Ed. Thomson Brooks / Cole.
- Nelson, D. L., og Cox, M. M. (2006). Lehninger Principles of Biochemistry 4. utgave. Ed Omega. Barcelona.
- Rawn, J. D. (1989). Biokjemi (Nr. 577.1 RAW). Red. Interamericana-McGraw-Hill
- Voet, D., og Voet, J. G. (2006). Biokjemi. Panamerican Medical Ed..



Ingen har kommentert denne artikkelen ennå.