
Elektronegativitetsskalaer, variasjon, nytte og eksempler

De elektronegativitet det er en relativ periodisk egenskap som gjelder et atoms evne til å tiltrekke seg elektrontetthet fra dets molekylære miljø. Det er tendensen til et atom å tiltrekke seg elektroner når det er festet til et molekyl. Dette gjenspeiles i oppførselen til mange forbindelser og i hvordan de samhandler intermolekylært med hverandre..
Ikke alle elementene tiltrekker seg elektroner fra tilstøtende atomer i samme grad. Når det gjelder de som lett gir elektrontetthet, sies det at de er det elektropositive, mens de som er "dekket" med elektroner er elektronegativ. Det er mange måter å forklare og observere denne egenskapen (eller konseptet).
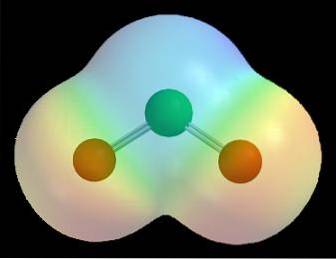
For eksempel i elektrostatiske potensielle kart for et molekyl (som det for klordioksid i bildet ovenfor, ClOto) effekten av de forskjellige elektronegativiteter for klor- og oksygenatomer blir observert.
Den røde fargen indikerer de elektronrike områdene av molekylet, δ-, og den blå fargen indikerer de elektronfattige regionene, δ +. Dermed, etter en serie beregningsberegninger, kan denne typen kart etableres; mange av dem viser et direkte forhold mellom plasseringen av elektronegative atomer og δ-.
Det kan også visualiseres som følger: i et molekyl er det mer sannsynlig at transitt av elektroner skjer i nærheten av de mest elektronegative atomer. Det er av denne grunn at for ClOto oksygenatomene (de røde sfærene) er omgitt av en rød sky, mens kloratomet (den grønne sfæren) er omgitt av en blålig sky.
Definisjonen av elektronegativitet avhenger av tilnærmingen gitt til fenomenet, det er flere skalaer som vurderer det fra visse aspekter. Imidlertid har alle skalaene til felles at de støttes av atomenes egenart.
Artikkelindeks
- 1 Elektronegativitetsskalaer
- 1.1 Pauling-skala
- 1.2 Mulliken skala
- 1.3 Skala av A.L. Allred og E. Rochow
- 2 Hvordan varierer elektronegativitet i det periodiske systemet?
- 2.1 Atomet i molekylet
- 3 Hva er det til??
- 4 eksempler (klor, oksygen, natrium, fluor)
- 5 Referanser
Elektronegativitetsskalaer
Elektronegativitet er ikke en egenskap som kan kvantifiseres, og den har heller ikke absolutte verdier. Hvorfor? Fordi tendensen til et atom for å tiltrekke elektrondensitet mot det er ikke den samme i alle forbindelser. Med andre ord: elektronegativitet varierer avhengig av molekylet.
Ja for ClO-molekyletto Hvis Cl-atomet ble byttet mot N-atomet, ville tendensen til O til å tiltrekke elektroner også endre seg; det kan øke (gjøre skyen rødere) eller redusere (miste farge). Forskjellen vil ligge i den nye dannede N-O-bindingen, slik at O-N-O-molekylet (nitrogendioksid, NOto).
Ettersom elektronegativiteten til et atom ikke er den samme for alle dets molekylære omgivelser, er det nødvendig å definere det i form av andre variabler. På denne måten er det verdier som fungerer som en referanse, og som tillater å forutsi for eksempel hvilken type binding som dannes (ionisk eller kovalent).
Pauling skala
Den store forskeren og vinneren av to Nobelpriser, Linus Pauling, foreslo i 1932 en kvantitativ (målbar) form av elektronegativet kjent som Pauling-skalaen. I den var elektronegativiteten til to elementer, A og B, som dannet bindinger, relatert til den ekstra energien forbundet med den ioniske karakteren til bindingen A-B.
Hvordan er dette? Teoretisk er kovalente bindinger de mest stabile, siden fordelingen av deres elektroner mellom to atomer er rettferdig; for molekyler A-A og B-B deler begge atomer paret elektroner av bindingen på samme måte. Imidlertid, hvis A er mer elektronegativ, vil paret være mer av A enn av B.
I så fall er A-B ikke lenger helt kovalent, selv om deres elektronegativiteter ikke avviker mye, kan det sies at deres binding har høy kovalent karakter. Når dette skjer, gjennomgår bindingen en liten ustabilitet og får ekstra energi som et produkt av elektronegativitetsforskjellen mellom A og B.
Jo større denne forskjellen er, desto større er energien til A-B-bindingen, og følgelig jo større er ionisk karakter av nevnte binding..
Denne skalaen representerer den mest brukte i kjemi, og elektronegativitetsverdiene oppsto fra tildelingen av en verdi på 4 for fluoratomet. Derfra kunne de beregne det av de andre elementene.
Mulliken skala
Mens Pauling-skalaen har å gjøre med energien knyttet til bindingene, er Robert Mulliken-skalaen mer relatert til to andre periodiske egenskaper: ioniseringsenergi (EI) og elektronaffinitet (AE).
Dermed er et element med høye EI- og AE-verdier veldig elektronegative, og vil derfor tiltrekke seg elektroner fra dets molekylære miljø..
Hvorfor? Fordi EI gjenspeiler hvor vanskelig det er å "rive" et eksternt elektron fra det, og AE hvor stabilt er anionet som dannes i gassfasen. Hvis begge egenskapene har høye størrelser, er elementet "elsker" elektroner..
Mulliken-elektronegativiteter beregnes med følgende formel:
ΧM = ½ (EI + AE)
Det vil si χM tilsvarer gjennomsnittsverdien til EI og AE.
I motsetning til Pauling-skalaen, som avhenger av hvilke atomer som danner bindinger, er den imidlertid relatert til egenskapene til valenstilstanden (med sine mest stabile elektroniske konfigurasjoner).
Begge skalaene genererer lignende elektronegativitetsverdier for elementene og er tilnærmet relatert til følgende ombygging:
ΧP = 1,35 (ΧM)1/2 - 1.37
Begge XM som XP de er dimensjonsløse verdier; det vil si at de mangler enheter.
Skala av A.L. Allred og E. Rochow
Det finnes andre elektronegativitetsskalaer, for eksempel Sanderson- og Allen-skalaene. Den som følger de to første er imidlertid Allred- og Rochow-skalaen (χAR). Denne gangen er den basert på den effektive kjernefysiske ladningen som et elektron opplever på overflaten av atomer. Derfor er det direkte relatert til kjernens attraktive styrke og skjermeffekten..
Hvordan varierer elektronegativitet fra det periodiske systemet?
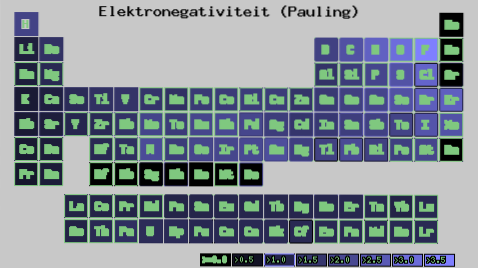
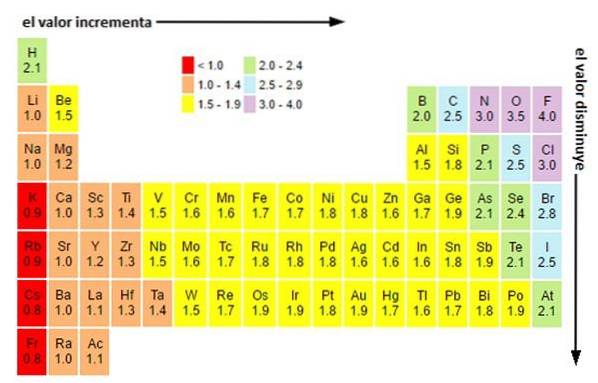
Uavhengig av skalaene eller verdiene du har, øker elektronegativiteten fra høyre til venstre i en periode, og fra bunn til topp i gruppene. Dermed øker den mot øvre høyre diagonal (teller ikke helium) til den møter fluor.
På bildet over kan du se hva som nettopp er blitt sagt. I det periodiske systemet uttrykkes Pauling-elektronegativiteter som en funksjon av fargene på cellene. Siden fluor er den mest elektronegative, har den en mer fremtredende lilla farge, mens den minst elektronegative (eller elektropositive) mørkere farger..
På samme måte kan det observeres at hodene til grupper (H, Be, B, C, etc.) har lysere farger, og at når man kommer ned gjennom gruppen, blir de andre elementene mørkere. Hva handler dette om? Svaret er igjen både i egenskapene EI, AE, Zef (effektiv kjernefysisk ladning) og i atomradiusen.
Atomet i molekylet
De enkelte atomer har en reell kjernefysisk ladning Z og de ytre elektronene lider av en effektiv kjernefysisk ladning som et resultat av skjermingseffekten..
Når den beveger seg over en periode, øker Zef på en slik måte at atomet trekker seg sammen; det vil si atomradiene reduseres over en periode.
Dette har som konsekvens at elektronene i øyeblikket binder et atom med et annet, vil "strømme" mot atomet med høyest Zef. Dette gir også en ionisk karakter til bindingen hvis det er en markant tendens for elektroner å gå mot et atom. Når dette ikke er tilfelle, snakker vi om en overveiende kovalent binding.
Av denne grunn varierer elektronegativiteten i henhold til atomradiene, Zef, som igjen er nært beslektet med EI og AE. Alt er en kjede.
Hva er den til?
Hva er elektronegativitet til? I prinsippet for å bestemme om en binær forbindelse er kovalent eller ionisk. Når elektronegativitetsforskjellen er veldig høy (med en hastighet på 1,7 enheter eller mer) sies det at forbindelsen er ionisk. Det er også nyttig å se i en struktur hvilke regioner som sannsynligvis er rikere på elektroner..
Herfra kan man forutsi hvilken mekanisme eller reaksjon forbindelsen kan gjennomgå. I elektronfattige regioner, δ +, kan negativt ladede arter virke på en bestemt måte; og i elektronrike regioner kan deres atomer samhandle på veldig spesifikke måter med andre molekyler (dipol-dipol-interaksjoner).
Eksempler (klor, oksygen, natrium, fluor)
Hva er elektronegativitetsverdiene for klor-, oksygen-, natrium- og fluoratomer? Hvem er den mest elektronegative etter fluor? Ved å bruke det periodiske systemet observeres det at natrium har en mørk lilla farge, mens fargene for oksygen og klor er veldig like..
Elektronegativitetsverdiene for skalaene Pauling, Mulliken og Allred-Rochow er:
Na (0,93, 1,21, 1,01).
Eller (3.44, 3.22, 3.50).
Cl (3.16, 3.54, 2.83).
F (3,98, 4,43, 4,10).
Merk at med de numeriske verdiene observeres en forskjell mellom negativitetene til oksygen og klor.
I følge Mulliken-skalaen er klor mer elektronegativ enn oksygen, i motsetning til Pauling og Allred-Rochow-skalaen. Elektronegativitetsforskjellen mellom de to elementene er enda tydeligere ved bruk av Allred-Rochow-skalaen. Og til slutt er fluor uavhengig av valgt skala den mest elektronegative..
Derfor, der det er et F-atom i et molekyl, betyr det at bindingen vil ha en høy ionisk karakter..
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave., Side 30 og 44). Mc Graw Hill.
- Jim Clark. (2000). Elektronegativitet. Hentet fra: chemguide.co.uk
- Anne Marie Helmenstine, Ph.D. (11. desember 2017). Elektronegativitetsdefinisjon og eksempler. Hentet fra: thoughtco.com
- Mark E. Tuckerman. (5. november 2011). Elektronegativitetsskala. Hentet fra: nyu.edu
- Wikipedia. (2018). Elektronegativitet. Hentet fra: es.wikipedia.org


Ingen har kommentert denne artikkelen ennå.