
Kjemiske bindingsegenskaper, hvordan de dannes, typer
De Kjemisk forbindelse det er kraften som klarer å holde sammen atomene som utgjør materie. Hver type materie har en karakteristisk kjemisk binding, som består av deltakelse av en eller flere elektroner. Dermed er kreftene som forener atomer i gasser forskjellige, for eksempel fra metaller.
Alle elementene i det periodiske systemet (med unntak av helium og de lette edelgassene) kan danne kjemiske bindinger med hverandre. Imidlertid er naturen til disse modifisert avhengig av hvilke elementer elektronene som danner dem kommer fra. En viktig parameter for å forklare typen obligasjoner er elektronegativitet.
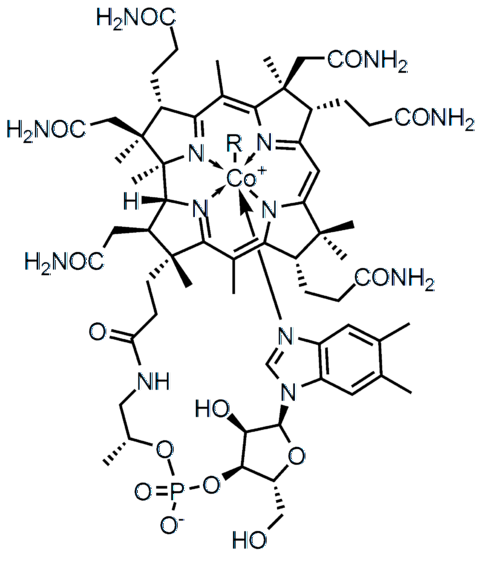
Forskjellen i elektronegativitet (ΔE) mellom to atomer definerer ikke bare typen kjemisk binding, men også de fysisk-kjemiske egenskapene til forbindelsen. Saltene er preget av å ha ioniske bindinger (høy AE), og mange av de organiske forbindelsene, slik som vitamin B12 (toppbilde), kovalente bindinger (ΔE lav).
I den høyere molekylære strukturen representerer hver av linjene en kovalent binding. Kilene indikerer at lenken kommer ut fra flyet (mot leseren), og de understrekede bak flyet (vekk fra leseren). Merk at det er dobbeltbindinger (=) og et koboltatom koordinert med fem nitrogenatomer og en R-sidekjede.
Men hvorfor dannes slike kjemiske bindinger? Svaret ligger i den energiske stabiliteten til atomer og elektroner som deltar. Denne stabiliteten må balansere de elektrostatiske frastøtningene som oppleves mellom elektronskyer og kjerner, og tiltrekningen som en kjerne utøver på elektronene til det nærliggende atomet..
Artikkelindeks
- 1 Definisjon av kjemisk binding
- 2 funksjoner
- 3 Hvordan dannes kjemiske bindinger?
- 3.1 Homonukleære forbindelser A-A
- 3.2 Heteronukleære forbindelser A-B
- 4 Typer kjemiske bindinger
- 4.1 -Kovalent binding
- 4,2 -Ionisk binding
- 4.3 Metallisk binding
- 5 Eksempler på lenker
- 6 Betydningen av den kjemiske bindingen
- 7 Referanser
Definisjon av den kjemiske bindingen
Mange forfattere har gitt definisjoner av den kjemiske bindingen. Av alle disse var det viktigste av fysisk-kjemikeren G. N. Lewis, som definerte den kjemiske bindingen som deltakelse av et par elektroner mellom to atomer. Hvis atomer A og B kan bidra med et enkelt elektron, dannes enkeltbindingen A: B eller A-B mellom dem.
Før bindingsdannelse er både A og B skilt med en ubestemt avstand, men ved binding er det nå en kraft som holder dem sammen i den diatomiske forbindelsen AB og en bindingsavstand (eller lengde).
Kjennetegn
Hva kjennetegner denne kraften som holder atomene sammen? Disse avhenger mer av typen kobling mellom A og B enn av deres elektroniske strukturer. For eksempel er A-B-lenken retningsbestemt. Hva betyr det? At kraften som utøves av foreningen av elektronparet kan vises på en akse (som om det var en sylinder).
Også, denne båndet krever energi for å bryte. Denne energimengden kan uttrykkes i enhetene kJ / mol eller cal / mol. Når nok energi er brukt på forbindelse AB (for eksempel ved varme), vil den dissosiere seg i de opprinnelige A- og B-atomene..
Jo mer stabil bindingen er, jo mer energi tar det å skille de bundne atomer..
På den annen side, hvis bindingen i forbindelse AB var ionisk, A+B-, da ville det være en ikke-retningsbestemt kraft. Hvorfor? Fordi+ utøver en attraktiv kraft på B- (og omvendt) som avhenger mer av avstanden som skiller begge ionene i rommet enn av deres relative plassering.
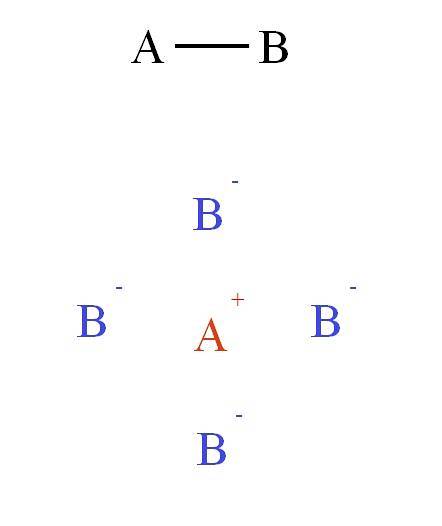
Dette tiltreknings- og frastøtningsfeltet samler andre ioner for å danne det som er kjent som krystallgitteret (toppbilde: kation A+ ligger omgitt av fire anioner B-, og disse fire kationene A+ og så videre).
Hvordan dannes kjemiske bindinger?
Homonukleære forbindelser A-A
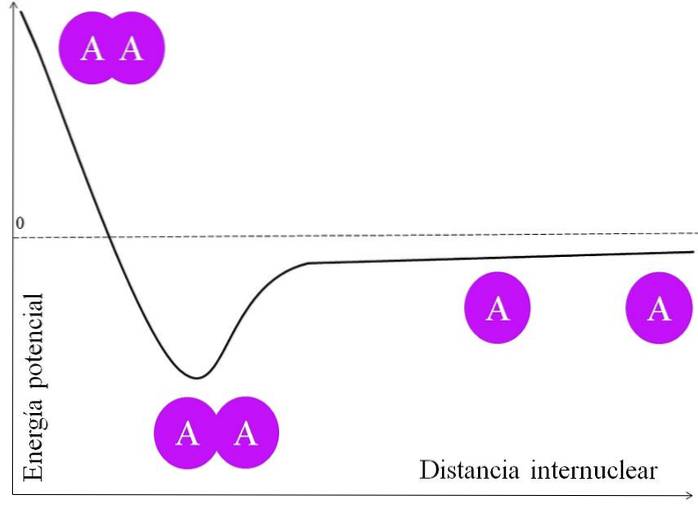
For at et par elektroner skal danne en binding, er det mange ting som må vurderes først. Kjernene, for å si de fra A, har protoner og er derfor positive. Når to A-atomer er veldig langt fra hverandre, det vil si i stor internukleær avstand (øvre bilde), opplever de ingen tiltrekning.
Når de to A-atomene nærmer seg kjernene, tiltrekker de seg elektronskyen til det nærliggende atomet (den lilla sirkelen). Dette er tiltrekningskraften (A på den nærliggende lilla sirkelen). Imidlertid avviser de to kjernene i A hverandre fordi de er positive, og denne kraften øker båndets potensielle energi (vertikal akse).
Det er en intern kjerneavstand der den potensielle energien når et minimum; det vil si at både attraktive og frastøtende krefter er balansert (de to A-atomene i den nedre delen av bildet).
Hvis denne avstanden avtar etter dette punktet, vil bindingen føre til at de to kjernene frastøter hverandre med stor kraft, og destabiliserer A-A-forbindelsen..
Så for at båndet skal dannes, må det være en energisk tilstrekkelig internuklear avstand; og videre må atomorbitalene overlappe riktig for at elektronene skal binde seg.
Heteronukleære forbindelser A-B
Hva om i stedet for to atomer av A, skulle ett av A og det andre av B bli med? I dette tilfellet vil den øvre grafen endre seg fordi et av atomene ville ha flere protoner enn det andre, og elektronskyene ville ha forskjellige størrelser..
Ettersom A-B-bindingen dannes ved passende internukleær avstand, vil elektronparet bli funnet hovedsakelig i nærheten av det mest elektronegative atomet. Dette er tilfelle med alle heteronukleære kjemiske forbindelser, som utgjør det store flertallet av de som er kjent (og vil være kjent).
Selv om det ikke er nevnt i dybden, er det mange variabler som direkte påvirker hvordan atomer nærmer seg og kjemiske bindinger dannes; noen er termodynamiske (er reaksjonen spontane?), elektroniske (hvor fulle eller tomme er atomene til atomene) og andre kinetiske.
Typer kjemiske bindinger
Koblinger har en rekke egenskaper som skiller dem fra hverandre. Flere av dem kan være innrammet i tre hovedklassifiseringer: kovalent, ionisk eller metallisk.
Selv om det er forbindelser hvis bindinger tilhører en enkelt type, består mange faktisk av en blanding av tegn av hver. Dette faktum skyldes forskjellen i elektronegativitet mellom atomene som danner bindingen. Dermed kan noen forbindelser være kovalente, men ha en viss ionisk karakter i sine bindinger..
På samme måte er typen binding, strukturen og molekylmassen nøkkelfaktorer som definerer de makroskopiske egenskapene til saken (lysstyrke, hardhet, løselighet, smeltepunkt, etc.).
-Kovalent binding
Kovalente bindinger er de som er blitt forklart så langt. I dem må to orbitaler (ett elektron i hver) overlappe med kjernene som er atskilt på en passende internukleær avstand..
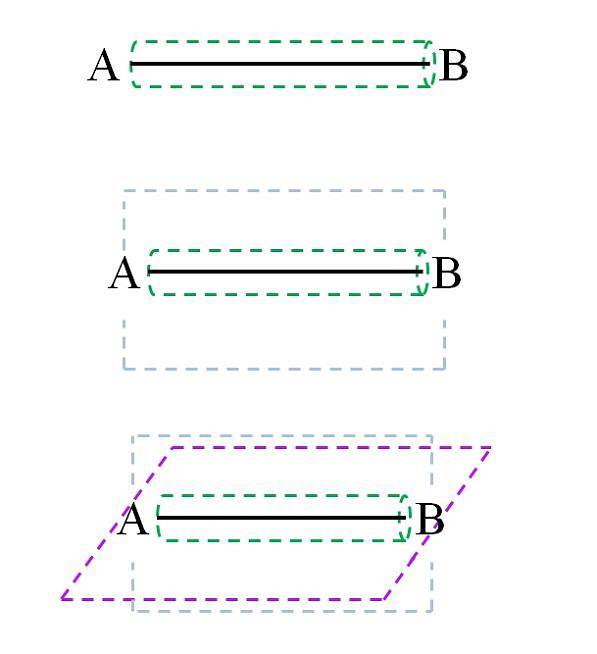
I følge molekylær orbitalteori (TOM), hvis overlappingen av orbitalene er frontal, vil det dannes en sigma σ-binding (som også kalles en enkel eller enkel binding). Mens om orbitalene er dannet av laterale og vinkelrette overlappinger i forhold til den internukleære aksen, vil vi ha π-bindingene (dobbelt og trippel):
Enkel lenke
Bindingen σ, som man kan se på bildet, dannes langs den internukleære aksen. Selv om det ikke er vist, kan A og B ha andre bindinger, og derfor deres egne kjemiske miljøer (forskjellige deler av molekylstrukturen). Denne typen ledd er preget av sin roterende kraft (grønn sylinder) og for å være den sterkeste av alle.
For eksempel kan enkeltbindingen i hydrogenmolekylet rotere på den internukleære (H-H) aksen. Tilsvarende kan et hypotetisk molekyl CA-AB gjøre det..
Koblinger C-A, A-A og A-B roterer; men hvis C eller B er atomer eller en gruppe klumpete atomer, hindres A-A-rotasjonen sterisk (fordi C og B vil kollidere).
Enkeltbindinger finnes i praktisk talt alle molekyler. Atomene deres kan ha hvilken som helst kjemisk hybridisering så lenge overlappingen av deres orbitaler er frontal. Går tilbake til strukturen av vitamin B12, hvilken som helst enkelt linje (-) angir en enkelt lenke (for eksempel -CONH lenkerto).
Dobbel lenke
Dobbelbindingen krever at atomene har (vanligvis) SP-hybridiseringto. Den rene p-bindingen, vinkelrett på de tre hybrid-sp-orbitaleneto, danner dobbeltbindingen, som fremstår som et gråaktig ark.
Merk at både enkeltbindingen (grønn sylinder) og dobbeltbindingen (grå ark) eksisterer samtidig. Imidlertid, i motsetning til enkeltbindinger, har ikke dobbeltbindinger den samme rotasjonsfriheten rundt den kjernefysiske aksen. Dette er fordi, for å rotere, må lenken (eller folien) bryte; prosess som trenger energi.
A-B-bindingen er også mer reaktiv enn A-B. Lengden er kortere og atomene A og B har kortere internukleær avstand; derfor er det større frastøting mellom begge kjernene. Å bryte både enkelt- og dobbeltbindinger krever mer energi enn det tar å skille atomene i A-B-molekylet..
I strukturen av vitamin B12 flere dobbeltbindinger kan observeres: C = O, P = O, og innenfor de aromatiske ringene.
Trippel obligasjon
Trippelbindingen er enda kortere enn dobbeltbindingen, og dens rotasjon er mer energisk hindret. I den dannes to vinkelrette π-bindinger (de grå og lilla arkene), så vel som en enkeltbinding.
Vanligvis må den kjemiske hybridiseringen av atomene A og B være sp: to sp-orbitaler 180 ° fra hverandre, og to rene p-orbitaler vinkelrett på den første. Merk at en trippelbinding ser ut som en padle, men uten rotasjonskraft. Denne bindingen kan representeres ganske enkelt som A≡B (N2N, nitrogenmolekyl Nto).
Av alle kovalente bindinger er dette den mest reaktive; men samtidig den som trenger mer energi for fullstendig separering av atomene (· A: +: B ·). Hvis vitamin B12 hadde en trippelbinding innenfor sin molekylære struktur, ville dens farmakologiske effekt drastisk endres.
Seks elektroner deltar i trippelbindinger; i dobbeltrom, fire elektroner; og i det enkle eller enkle, to.
Dannelsen av en eller flere av disse kovalente bindingene avhenger av atomenes elektroniske tilgjengelighet; det vil si hvor mange elektroner som deres orbitaler trenger for å tilegne seg en oktett av valens.
Ikke-polær binding
En kovalent binding består av en lik deling av et elektronpar mellom to atomer. Men dette gjelder strengt tatt bare i tilfelle hvor begge atomer har like elektronegativiteter; det vil si den samme tendensen til å tiltrekke elektrontetthet fra omgivelsene til en kompositt.
Ikke-polare bindinger er preget av en null elektronegativitetsforskjell (ΔE≈0). Dette skjer i to situasjoner: i en homonukleær forbindelse (Ato), eller hvis det kjemiske miljøet på begge sider av bindingen er ekvivalent (H3C-CH3, etanmolekyl).
Eksempler på ikke-polære bindinger er sett i følgende forbindelser:
-Hydrogen (H-H)
-Oksygen (O = O)
-Nitrogen (N≡N)
-Fluor (F-F)
-Klor (Cl-Cl)
-Acetylen (HC≡CH)
Polarbindinger
Når det er en markant forskjell i elektronegativitet ΔE mellom begge atomene, dannes et dipolmoment langs bindingsaksen: Aδ+-Bδ-. Når det gjelder den heteronukleære forbindelsen AB, er B det mest elektronegative atomet, og derfor har den en høyere elektrontetthet δ-; mens A, den minste elektronegative, ladningsmangel δ+.
For at de polare bindingene skal oppstå, må to atomer med forskjellige elektronegativiteter være sammen; og dermed danne heteronukleære forbindelser. A-B ligner en magnet: den har en positiv og en negativ pol. Dette gjør at den kan samhandle med andre molekyler gjennom dipol-dipolkrefter, blant annet hydrogenbindinger..
Vann har to polare kovalente bindinger, H-O-H, og molekylgeometrien er vinkelaktig, noe som øker dipolmomentet. Hvis geometrien var lineær, ville havene fordampet og vannet ville ha et lavere kokepunkt.
Det faktum at en forbindelse har polare bindinger, innebærer ikke at den er polær. For eksempel karbontetraklorid, CCl4, har fire polære C-Cl-bindinger, men på grunn av deres tetraedriske arrangement ender dipolmomentet med å bli annullert i vekt.
Dative eller koordinering lenker
Når et atom gir opp et par elektroner for å danne en kovalent binding med et annet atom, snakker vi om en dativ- eller koordineringsbinding. For eksempel å ha B: det tilgjengelige elektronparet, og A (eller A+), en elektronisk ledighet, dannes lenken B: A.
I strukturen av vitamin B12 de fem nitrogenatomer er bundet til metallsenteret til Co ved denne typen kovalent binding. Disse nitrogenene gir opp sitt gratis elektronpar til Co-kationen.3+, koordinering av metallet med dem (Co3+: N-)
Et annet eksempel kan bli funnet i protoneringen av et ammoniakkmolekyl for å danne ammoniakk:
H3N: + H+ => NH4+
Merk at det i begge tilfeller er nitrogenatomet som bidrar med elektronene; derfor oppstår dativ eller koordinering kovalent binding når et atom alene bidrar med paret elektroner.
På samme måte kan vannmolekylet protoneres til å bli hydronium (eller oksonium) kation:
HtoO + H+ => H3ELLER+
I motsetning til ammoniumkationen har hydronium fremdeles et fritt elektronpar (H3ELLER:+); det er imidlertid veldig vanskelig for det å akseptere en annen proton for å danne den ustabile hydroniumdikasjonen, H4ELLERto+.
-Jonisk bånd

Bildet er en hvit saltbakke. Saltene er preget av å ha krystallinske strukturer, det vil si symmetriske og ordnet; høye smeltepunkter og kokepunkter, høye elektriske ledningsevner ved smelting eller oppløsning, og dessuten er ionene sterkt bundet av elektrostatiske interaksjoner.
Disse interaksjonene utgjør det som er kjent som den ioniske bindingen. På det andre bildet ble det vist et kation A+ omgitt av fire anioner B-, men dette er en 2D-representasjon. I tre dimensjoner, A+ skal ha andre anioner B- fremover og bak flyet, og danner forskjellige strukturer.
Dermed A+ den kan ha seks, åtte eller til og med tolv naboer. Antallet naboer som omgir et ion i en krystall er kjent som koordinasjonsnummeret (N.C). For hvert N.C er en type krystallinsk ordning assosiert, som igjen utgjør en fast fase av saltet.
De symmetriske og fasetterte krystallene som er sett i saltene skyldes likevekten som er etablert av tiltrekningsinteraksjonene (A+ B-) og frastøting (A+ TIL+, B- B-) elektrostatisk.
Opplæring
Men hvorfor A + og B-, eller Na+ og Cl-, danner ikke Na-Cl kovalente bindinger? Fordi kloratomet er mye mer elektronegativt enn natriummetall, som også kjennetegnes ved veldig enkelt å gi opp elektronene. Når disse elementene møtes, reagerer de eksotermt for å produsere bordsalt:
2Na (s) + Clto(g) => 2NaCl (s)
To natriumatomer avgir sitt enkeltvalenselektron (Na) til det diatomiske molekylet Clto, å danne Cl-anionene-.
Samspillet mellom natriumkationer og kloridioner, selv om de representerer en svakere binding enn kovalente, er i stand til å holde dem sterkt forenet i det faste stoffet; og dette faktum gjenspeiles i saltets høye smeltepunkt (801ºC).
Metallisk binding

Den siste typen kjemisk binding er metallisk. Dette kan finnes på hvilken som helst metall- eller legeringsdel. Den er preget av å være spesiell og forskjellig fra de andre, på grunn av at elektroner ikke passerer fra ett atom til et annet, men snarere, som et hav, gjennom metallkrystallen.
Dermed blander metallatomer, for eksempel kobber, deres valensorbitaler med hverandre for å danne ledningsbånd; gjennom hvilke elektroner (s, p, d eller f) passerer rundt atomene og holder dem tett sammen.
Avhengig av antall elektroner som passerer gjennom metallkrystallet, orbitalene som er gitt for båndene og pakningen av atomer, kan metallet være mykt (som alkalimetaller), hardt, skinnende eller en god leder av elektrisitet og varm.
Kraften som holder sammen atomene til metaller, slik som de som utgjør den lille mannen i bildet og den bærbare datamaskinen, er større enn saltene.
Dette kan bekreftes eksperimentelt fordi krystallene til saltene kan deles i flere halvdeler før en mekanisk kraft; mens en metalldel (som består av veldig små krystaller) blir deformert.
Eksempler på lenker
Følgende fire forbindelser omfatter hvilke typer kjemiske bindinger som er forklart:
-Natriumfluorid, NaF (Na+F-): ionisk.
-Natrium, Na: metallisk.
-Fluor, Fto (F-F): ikke-polær kovalent, på grunn av det faktum at det er en null ΔE mellom begge atomene fordi de er identiske.
-Hydrogenfluorid, HF (HF): polær kovalent, siden fluor i denne forbindelsen er mer elektronegativ enn hydrogen.
Det er forbindelser, som vitamin B12, besitter både polære og ioniske kovalente bindinger (i den negative ladningen av fosfatgruppen -PO4--). I noen komplekse strukturer, for eksempel metallklynger, kan alle disse typer lenker til og med eksistere.
Matter tilbyr i alle manifestasjoner eksempler på kjemiske bindinger. Fra steinen på bunnen av en dam og vannet som omgir den, til paddene som kvaker i kantene.
Selv om bindingene kan være enkle, gir antall og romlige arrangement av atomene i molekylstrukturen plass for et rikt mangfold av forbindelser..
Betydningen av den kjemiske bindingen
Hva er viktigheten av den kjemiske bindingen? Det uberegnelige antall konsekvenser som fraværet av den kjemiske bindingen vil frigjøre, understreker dens enorme betydning i naturen:
-Uten den ville ikke farger eksistere, da elektronene ikke ville absorbere elektromagnetisk stråling. Støv- og ispartiklene i atmosfæren ville forsvinne, og derfor ville den blå fargen på himmelen bli mørk..
-Karbon kunne ikke danne sine endeløse kjeder, hvorfra billioner av organiske og biologiske forbindelser kommer.
-Proteiner kunne ikke engang defineres i deres sammensatte aminosyrer. Sukker og fett ville forsvinne, så vel som karbonforbindelser i levende organismer.
-Jorden ville stå uten en atmosfære, for i fravær av kjemiske bindinger i gassene, ville det ikke være noen kraft til å holde dem sammen. Det ville heller ikke være det minste intermolekylære samspillet mellom dem.
-Fjellene kan forsvinne fordi bergarter og mineraler, selv om de er tunge, ikke kunne inneholde atomene pakket i krystallinske eller amorfe strukturer..
-Verden ville bestå av ensomme atomer som ikke var i stand til å danne faste eller flytende stoffer. Dette vil også resultere i at all transformasjon av materie forsvinner; det vil si at det ikke vil være noen kjemisk reaksjon. Bare flyktige gasser overalt.
Referanser
- Harry B. Gray. (1965). Elektroner og kjemisk binding. W.A. BENJAMIN, INC. P 36-39.
- Whitten, Davis, Peck & Stanley. Kjemi. (8. utg.). CENGAGE Learning, s 233, 251, 278, 279.
- Nave R. (2016). Kjemisk binding. Gjenopprettet fra: hyperphysics.phy-astr.gsu.edu
- Kjemiske bindetyper. (3. oktober 2006). Hentet fra: dwb4.unl.edu
- Dannelse av kjemiske bindinger: Elektronenes rolle. [PDF]. Gjenopprettet fra: cod.edu
- CK-12 Foundation. (s.f.). Dannelse av energi og kovalent binding. Gjenopprettet fra: chem.libretexts.org
- Quimitube. (2012). Koordinat eller dativ kovalent binding. Gjenopprettet fra: quimitube.com



Ingen har kommentert denne artikkelen ennå.