
Krystallstrukturstruktur, typer og eksempler
De krystallstruktur Det er en av de faste tilstandene atomer, ioner eller molekyler kan adoptere i naturen, noe som er preget av å ha en høy romlig orden. Dette er med andre ord bevis på den “korpuskulære arkitekturen” som definerer mange kropper med glassete og skinnende utseende..
Hva fremmer eller hvilken kraft er ansvarlig for denne symmetrien? Partiklene er ikke alene, men de samhandler med hverandre. Disse samspillene forbruker energi og påvirker stabiliteten til de faste stoffene, slik at partiklene prøver å tilpasse seg for å minimere dette energitapet..

Så deres iboende natur fører dem til å plassere seg i det mest stabile romlige arrangementet. For eksempel kan dette være den der frastøting mellom ioner med samme ladninger er minimal, eller hvor noen atomer - som metalliske - også opptar størst mulig volum i pakningene..
Ordet "krystall" har en kjemisk betydning som kan bli fremstilt feil for andre kropper. Kjemisk refererer det til en ordnet struktur (mikroskopisk) som for eksempel kan bestå av DNA-molekyler (en DNA-krystall).
Imidlertid blir det ofte misbrukt å referere til glassholdige gjenstander eller overflater, for eksempel speil eller flasker. I motsetning til ekte krystaller består glass av en amorf struktur (uordnet) av silikater og mange andre tilsetningsstoffer..
Artikkelindeks
- 1 Struktur
- 1.1 Enhetscelle
- 2 typer
- 2.1 I henhold til det krystallinske systemet
- 2.2 I henhold til kjemisk natur
- 3 eksempler
- 3.1 K2Cr2O7 (triklinikksystem)
- 3.2 NaCl (kubisk system)
- 3.3 ZnS (wurtzite, sekskantet system)
- 3.4 CuO (monoklinisk system)
- 4 Referanser
Struktur
På bildet over er noen smaragdperler illustrert. Akkurat som disse har mange andre mineraler, salter, metaller, legeringer og diamanter en krystallinsk struktur; men hvilket forhold har ordren sin med symmetrien?
Hvis en krystall, hvis partikler kan observeres med det blotte øye, påføres symmetrioperasjoner (invertere den, rotere den i forskjellige vinkler, reflektere den i et plan osv.), Vil det bli funnet at den forblir intakt i alle dimensjoner av plass..
Det motsatte forekommer for et amorft fast stoff, hvorfra forskjellige ordrer oppnås ved å underkaste det en symmetrioperasjon. I tillegg mangler den strukturelle repetisjonsmønstre, som viser tilfeldigheten i fordelingen av partiklene..
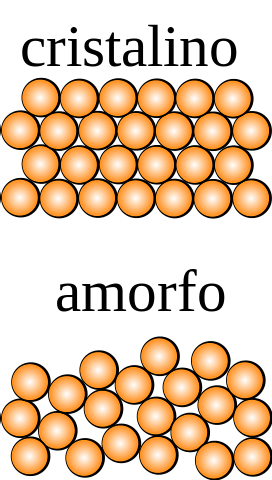
Hva er den minste enheten som utgjør det strukturelle mønsteret? I det øvre bildet er det krystallinske faste stoffet symmetrisk i rommet, mens det amorfe ikke er det..
Hvis det ble tegnet firkanter som lukkede oransje kuler og symmetrioperasjoner ble brukt på dem, ville det bli funnet at de genererer andre deler av krystallet.
Ovennevnte gjentas med mindre og mindre firkanter, til de finner den som er asymmetrisk; den som går foran den i størrelse er per definisjon enhetscellen.
Enhetscelle
Enhetscellen er det minste strukturelle uttrykket som tillater fullstendig reproduksjon av det krystallinske faste stoffet. Fra dette er det mulig å montere glasset og flytte det i alle retninger av rommet.
Det kan betraktes som en liten skuff (koffert, bøtte, beholder osv.) Der partiklene, representert med kuler, plasseres etter et fyllemønster. Dimensjonene og geometriene til denne boksen avhenger av lengden på aksene (a, b og c), samt vinklene mellom dem (α, β og γ).
Den enkleste av alle enhetscellene er den med den enkle kubiske strukturen (øvre bilde (1)). I dette opptar midten av kulene hjørnene på kuben, fire ved foten og fire på taket..
I dette arrangementet opptar kulene bare 52% av det totale volumet av kuben, og siden naturen avskyr et vakuum, er det ikke mange forbindelser eller elementer som bruker denne strukturen..
Imidlertid, hvis kulene er ordnet i samme kube på en slik måte at man opptar midten (kubikk sentrert i kroppen, bcc), vil det være en mer kompakt og effektiv pakking (2). Nå opptar kulene 68% av det totale volumet.
På den annen side, i (3) opptar ingen kule sentrum av kuben, men midten av ansiktene, og de opptar alle opptil 74% av det totale volumet (ansiktssentrert kubikk, cc).
Dermed kan man se at for den samme kuben kan andre ordninger oppnås, som varierer måten kulene er pakket på (ioner, molekyler, atomer, etc.).
Typer
Krystallstrukturer kan klassifiseres i henhold til deres krystallsystemer eller den kjemiske naturen til partiklene deres..
For eksempel er det kubiske systemet det vanligste av alle, og mange krystallinske faste stoffer styres av det; Imidlertid gjelder det samme systemet både ioniske og metalliske krystaller..
I henhold til det krystallinske systemet
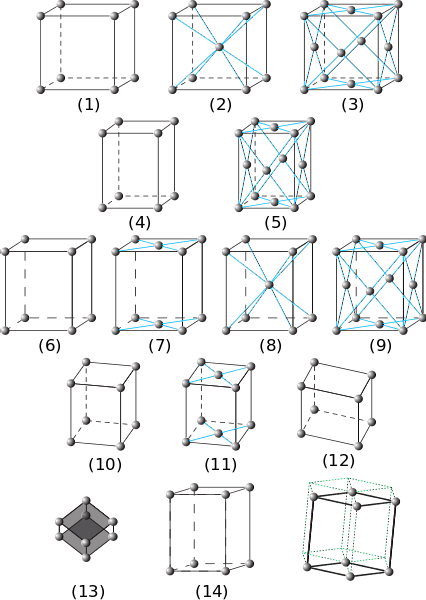
I det forrige bildet er de syv hovedkrystallsystemene representert. Det kan bemerkes at det faktisk er fjorten av disse, som er produktet av andre former for emballasje for de samme systemene og utgjør Bravais-nettverkene..
Fra (1) til (3) er krystaller med kubiske krystallsystemer. I (2) observeres det (av de blå stripene) at sfæren i midten og hjørnene samhandler med åtte naboer, så sfærene har et koordinasjonsnummer på 8. Og i (3) er koordinasjonstallet 12 ( for å se den må du duplisere kuben i hvilken som helst retning).
Elementene (4) og (5) tilsvarer enkle og ansiktssentrerte tetragonale systemer. I motsetning til kubikken er c-aksen lengre enn a- og b-aksene.
Fra (6) til (9) er de ortorhombiske systemene: fra enkle og sentrerte på basene (7), til de som er sentrert på kroppen og ansiktene. I disse α er β og γ 90º, men alle sidene har forskjellige lengder.
Figurene (10) og (11) er de monokliniske krystallene og (12) er den trikliniske, den siste som viser ulikheter i alle sine vinkler og akser..
Element (13) er det romboedriske systemet, analogt med det kubiske, men med en vinkel γ forskjellig fra 90 °. Endelig er det de sekskantede krystallene
Forskyvningene til elementene (14) stammer fra det sekskantede prisme sporet av de grønne prikkede linjene.
I henhold til dets kjemiske natur
- Hvis krystallene består av ioner, er de ioniske krystaller som er tilstede i salter (NaCl, CaSO4, CuClto, KBr, etc.)
- Molekyler som glukose danner (når de kan) molekylære krystaller; i dette tilfellet de berømte sukkerkrystallene.
- Atomer hvis bindinger i hovedsak er kovalente, danner kovalente krystaller. Slike er tilfellene av diamant eller silisiumkarbid.
- Metaller som gull danner også kompakte kubiske strukturer, som utgjør metalliske krystaller..
Eksempler
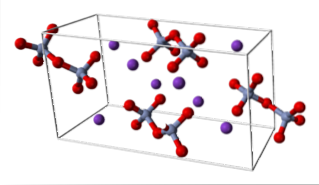
KtoCrtoELLER7 (triklinikksystem)
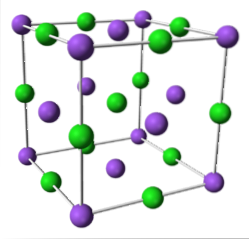
NaCl (kubisk system)
ZnS (wurtzite, sekskantet system)
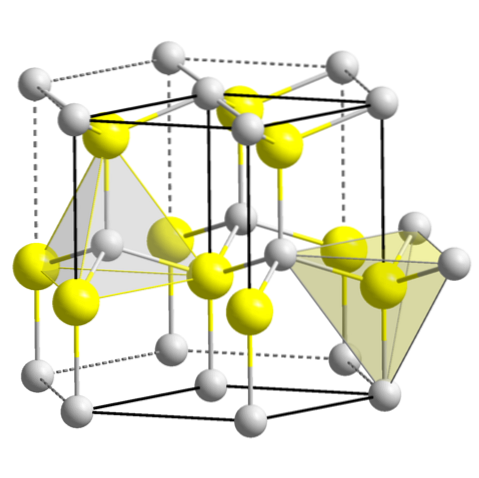
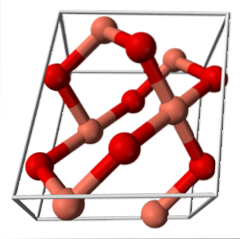
CuO (monoklinisk system)
Referanser
- Quimitube. (2015). Hvorfor "krystaller" ikke er krystaller. Hentet 24. mai 2018 fra: quimitube.com
- Pressebøker. 10.6 Gitterstrukturer i krystallinske faste stoffer. Hentet 26. mai 2018 fra: opentextbc.ca
- Crystal Structures Academic Resource Center. [PDF]. Hentet 24. mai 2018 fra: web.iit.edu
- Ming. (30. juni 2015). Typer krystallstrukturer. Hentet 26. mai 2018 fra: crystalvisions-film.com
- Helmenstine, Anne Marie, Ph.D. (31. januar 2018). Typer krystaller. Hentet 26. mai 2018 fra: thoughtco.com
- KHI. (2007). Krystallinske strukturer. Hentet 26. mai 2018, fra: folk.ntnu.no
- Paweł Maliszczak. (25. april 2016). Grove smaragdkrystaller fra Panjshir Valley Afghanistan. [Figur]. Hentet 24. mai 2018 fra: commons.wikimedia.org
- Napy1kenobi. (26. april 2008). Bravais gitter. [Figur]. Hentet 26. mai 2018 fra: commons.wikimedia.org
- Bruker: Sbyrnes321. (21. november 2011). Krystallinsk eller amorf. [Figur]. Hentet 26. mai 2018 fra: commons.wikimedia.org



Ingen har kommentert denne artikkelen ennå.