
Etanstruktur, egenskaper, bruksområder og risikoer
De etan er et enkelt hydrokarbon med formel CtoH6 med en fargeløs og luktfri naturgass som har en svært verdifull og diversifisert bruk i syntesen av etylen. I tillegg er det en av de jordgassene som også har blitt oppdaget i andre planeter og stjernekropper rundt solsystemet. Det ble oppdaget av forskeren Michael Faraday i 1834.
Blant det store antallet organiske forbindelser dannet av karbon- og hydrogenatomer (kjent som hydrokarboner), er det de som er i gassform ved omgivelsestemperaturer og trykk, som er mye brukt i mange bransjer..
Disse kommer vanligvis fra den gassformige blandingen kalt "naturgass", et produkt av høy verdi for menneskeheten, og utgjør alkaner av blant annet metan, etan, propan og butan; klassifisert i henhold til antall karbonatomer i kjeden.
Artikkelindeks
- 1 Kjemisk struktur
- 1.1 Syntese av etan
- 2 eiendommer
- 2.1 Løselighet av etan
- 2.2 Krystallisering av etan
- 2.3 Forbrenning av etan
- 2.4 Etan i atmosfæren og i himmellegemer
- 3 bruksområder
- 3.1 Etylenproduksjon
- 3.2 Grunnleggende kjemisk dannelse
- 3.3 Kjølemiddel
- 4 Risiko for etan
- 5 Referanser
Kjemisk struktur
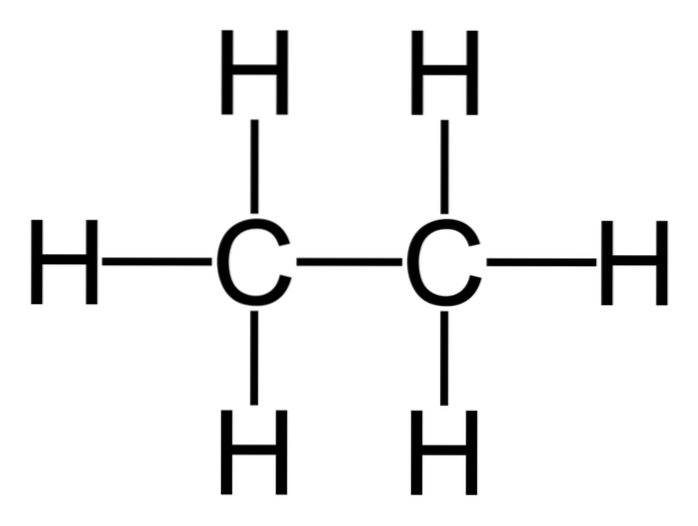
Etan er et molekyl med formel CtoH6, vanligvis sett på som en forening av to metylgrupper (-CH3) for å danne hydrokarbonet fra en enkelt karbon-karbonbinding. Det er også den enkleste organiske forbindelsen etter metan, representert som følger:
H3C-CH3
Karbonatomer i dette molekylet har sp-type hybridisering3, slik at molekylbindingene gir fri rotasjon.
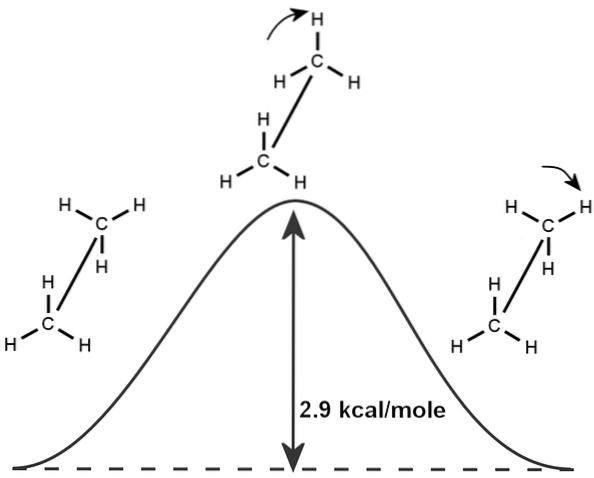
På samme måte er det et iboende fenomen av etan, som er basert på rotasjonen av dens molekylære struktur og den minste energien som kreves for å produsere en 360 graders bindingsrotasjon, som forskere har kalt "etanbarrieren".
Av denne grunn kan etan vises i forskjellige konfigurasjoner avhengig av rotasjon, selv om den mest stabile konformasjonen eksisterer der hydrogenene er motsatt hverandre (som vist i figuren).
Syntese av etan
Etan kan lett syntetiseres fra Kolbe-elektrolyse, en organisk reaksjon der to trinn oppstår: en elektrokjemisk dekarboksylering (fjerning av karboksylgruppen og frigjøring av karbondioksid) av to karboksylsyrer, og kombinasjonen av produktmellemproduktene for å danne en kovalent binding.
Tilsvarende gir elektrolyse av eddiksyre dannelse av etan og karbondioksid, og denne reaksjonen brukes til å syntetisere førstnevnte..
Oksidasjonen av eddiksyreanhydrid ved innvirkning av peroksider, et konsept som ligner på Kolbes elektrolyse, resulterer også i dannelsen av etan..
På samme måte kan den skilles effektivt fra naturgass og metan ved en flytende prosess, ved hjelp av kryogene systemer for å fange opp denne gassen og skille den fra blandinger med andre gasser..
Turboekspansjonsprosessen er foretrukket for denne rollen: gassblandingen føres gjennom en turbin og genererer en ekspansjon av den samme til temperaturen faller under -100 ° C.
Allerede på dette tidspunktet kan komponentene i blandingen differensieres, slik at det flytende etanet blir separert fra det gassformige metanet og de andre artene som er involvert i bruk av destillasjon.
Eiendommer
Etan forekommer i naturen som en luktfri og fargeløs gass ved standardtrykk og temperaturer (1 atm og 25 ° C). Den har et kokepunkt på -88,5 ° C og et smeltepunkt på -182,8 ° C. Det påvirkes heller ikke av eksponering for sterke syrer eller baser..
Etanløselighet
Etanmolekyler er symmetriske i konfigurasjon og har svake tiltrekningskrefter som holder dem sammen, kalt dispersjonskrefter..
Når etan forsøkes å oppløses i vann, er de attraktive kreftene som dannes mellom gass og væske veldig svake, så det er veldig vanskelig for etan å binde seg med vannmolekyler..
Av denne grunn er løseligheten av etan betydelig lav, og øker litt når systemtrykket økes..
Etan-krystallisering
Etan kan stivnes, noe som resulterer i dannelsen av ustabile etan-krystaller med en kubisk krystallinsk struktur..
Med en reduksjon i temperaturen utover -183,2 ºC blir denne strukturen monoklinisk, og øker stabiliteten til molekylet.
Etanforbrenning
Dette hydrokarbonet, selv om det ikke er mye brukt som drivstoff, kan brukes i forbrenningsprosesser for å generere karbondioksid, vann og varme, som er representert som følger:
2 CtoH6 + 7Oto → 4COto + 6HtoO + 3120 kJ
Det er også muligheten for å brenne dette molekylet uten overflødig oksygen, som er kjent som "ufullstendig forbrenning", og som resulterer i dannelse av amorf karbon og karbonmonoksid i en uønsket reaksjon, avhengig av mengden oksygen som påføres.
2 CtoH6 + 3Oto → 4C + 6HtoO + varme
2 CtoH6 + 4. plassto → 2C + 2CO + 6HtoO + varme
2 CtoH6 + 5Oto → 4CO + 6HtoO + varme
I dette området forekommer forbrenning av en serie med frie radikaler, som er nummerert i hundrevis av forskjellige reaksjoner. For eksempel kan i ufullstendige forbrenningsreaksjoner dannes forbindelser som formaldehyd, acetaldehyd, metan, metanol og etanol..
Dette vil avhenge av forholdene som reaksjonen skjer under og de frie radikaler som er involvert. Etylen kan også dannes ved høye temperaturer (600-900 ° C), som er et meget ønsket produkt av industrien..
Etan i atmosfæren og i himmellegemer
Etan er til stede i atmosfæren på planeten Jorden i spor, og det mistenkes at mennesker har klart å doble denne konsentrasjonen siden de begynte å praktisere industrielle aktiviteter.
Forskere tror at mye av den nåværende tilstedeværelsen av etan i atmosfæren skyldes forbrenning av fossile brensler, selv om det globale utslippet av etan har sunket med nesten halvparten siden teknologiene for produksjon av skifergass ble forbedret (en naturgasskilde).
Denne arten produseres også naturlig av effekten av sollys på atmosfærisk metan, som rekombinerer og danner et etanmolekyl..
Flytende etan eksisterer på overflaten av Titan, en av Saturns måner. Dette skjer i større mengde i Vid Flumina-elven, som renner i mer enn 400 kilometer mot et av havene sine. Denne forbindelsen er også påvist på kometer og på overflaten av Pluto.
applikasjoner
Etylenproduksjon
Bruk av etan er hovedsakelig basert på produksjon av etylen, det organiske produktet som er mest brukt i verdensproduksjon, gjennom en prosess kjent som dampfase-krakking..
Denne prosessen består i å føre et tilførsel av etan fortynnet med damp til en ovn, og raskt oppvarme det uten oksygen..
Reaksjonen skjer ved en ekstremt høy temperatur (mellom 850 og 900 ° C), men oppholdstiden (tiden etan tilbringer i ovnen) må være kort for at reaksjonen skal være effektiv. Ved høyere temperaturer genereres mer etylen.
Grunnleggende kjemisk dannelse
Etan har også blitt studert som en hovedkomponent i dannelsen av basiske kjemikalier. Oksidativ klorering er en av prosessene som er foreslått for å oppnå vinylklorid (en komponent av PVC), og erstatter andre mindre økonomiske og mer kompliserte.
Kjølemiddel
Til slutt brukes etan som kjølemiddel i vanlige kryogene systemer, og viser også muligheten til å fryse små prøver i laboratoriet for analyse..
Det er en veldig god erstatning for vann, som tar lenger tid å avkjøle delikate prøver, og kan også føre til at det dannes skadelige iskrystaller..
Risiko for etan
-Etan har evnen til å antennes, hovedsakelig når det binder seg med luft. Ved 3,0 til 12,5 volum% etan i luft kan det dannes en eksplosiv blanding.
-Det kan begrense oksygenet i luften det er funnet i, og av den grunn utgjør det en risikofaktor for kvelning for mennesker og dyr som er til stede og utsatt.
-Etan i frossen flytende form kan brenne huden alvorlig hvis den kommer i direkte kontakt med den, og også fungere som et kryogent medium for ethvert objekt det berører, og fryse det umiddelbart.
-Flytende etangasser er tyngre enn luft og konsentrerer seg på bakken, dette kan utgjøre en fare for antenning som kan generere en forbrenningskjedereaksjon.
-Inntak av etan kan forårsake kvalme, oppkast og indre blødninger. Innånding, i tillegg til kvelning, forårsaker hodepine, forvirring og humørsvingninger. Død fra hjertestans er mulig ved høy eksponering.
-Det representerer en klimagass som sammen med metan og karbondioksid bidrar til global oppvarming og klimaendringer generert av menneskelig forurensning. Heldigvis er den mindre rikelig og holdbar enn metan, og absorberer mindre stråling enn metan..
Referanser
- Britannica, E. (s.f.). Etan. Hentet fra britannica.com
- Nes, G. V. (s.f.). Enkeltkrystallstrukturer og elektrondensitetsfordelinger av etan, etylen og acetylen. Gjenopprettet fra rug.nl
- Nettsteder, G. (s.f.). Etan: Kilder og vasker. Hentet fra sites.google.com
- SoftSchools. (s.f.). Etanformel. Gjenopprettet fra softschools.com
- Wikipedia. (s.f.). Etan. Hentet fra en.wikipedia.org



Ingen har kommentert denne artikkelen ennå.