
Etylenglykolegenskaper, kjemisk struktur, bruksområder
De etylenglykol det er den enkleste organiske forbindelsen i glykolfamilien. Dens kjemiske formel er CtoH6ELLERto, mens dens strukturformel er HOCHto-CHtoÅH. En glykol er en alkohol karakterisert ved å ha to hydroksylgrupper (OH) festet til to nærliggende karbonatomer i en alifatisk kjede.
Etylenglykol er en klar, fargeløs og luktfri væske. På bildet nedenfor har du et utvalg av ham i en krukke. I tillegg har den en søt smak og er veldig hygroskopisk. Det er en litt flyktig væske, så den utøver et veldig lite damptrykk, med dampens tetthet større enn tettheten av luft..

Etylenglykol er en forbindelse med stor løselighet i vann, i tillegg til å være blandbar med mange organiske forbindelser; slik som kortkjedede alifatiske alkoholer, aceton, glyserol, etc. Dette skyldes deres evne til å donere og akseptere hydrogenbindinger fra protiske løsemidler (som har H).
Etylenglykol polymeriserer i mange forbindelser, hvis navn ofte forkortes til PEG og et tall som indikerer deres omtrentlige molekylvekt. PEG 400 er for eksempel en relativt liten, flytende polymer. Mens store PEG er hvite faste stoffer med fettete utseende.
Egenskapen til etylenglykol for å senke smeltepunktet og øke vannets kokepunkt, tillater bruk som kjølevæske og antikoagulasjonsmiddel i kjøretøyer, fly og datautstyr.
Artikkelindeks
- 1 eiendommer
- 1.1 Navn
- 1.2 Molar masse
- 1.3 Fysisk utseende
- 1.4 Lukt
- 1.5 Smak
- 1.6 Tetthet
- 1.7 Smeltepunkt
- 1.8 Kokepunkt
- 1.9 Løselighet i vann
- 1.10 Løselighet i andre løsningsmidler
- 1.11 Flammepunkt
- 1.12 Damptetthet
- 1.13 Damptrykk
- 1.14 Nedbrytning
- 1.15 Lagringstemperatur
- 1.16 Forbrenningsvarme
- 1.17 Fordampningsvarme
- 1.18 Overflatespenning
- 1.19 Brytningsindeks
- 1,20 Dissosiasjonskonstant
- 1,21 pH
- 1.22 Octanol / vann fordelingskoeffisient
- 2 Kjemisk struktur
- 3 Produksjon
- 3.1 Oksidasjon av etylen
- 3.2 Hydrolyse av etylenoksyd
- 3.3 Omega-prosess
- 4 bruksområder
- 4.1 Kjølevæske og frostvæske
- 4.2 Dehydrering
- 4.3 Produksjon av polymerer
- 4.4 Eksplosiver
- 4.5 Trebeskyttelse
- 4.6 Andre applikasjoner
- 5 Forgiftning og risiko
- 5.1 Symptomer fra eksponering
- 5.2 Svelging
- 5.3 Økologiske konsekvenser av etylenglykol
- 6 Referanser
Eiendommer
Navn
Etan-1,2-diol (IUPAC), etylenglykol, monoetylenglykol (MEG), 1-2-dihydroksyetan.
Molarmasse
62,068 g / mol
Fysisk utseende
Klar, fargeløs og tyktflytende væske.
Lukt
Toalett
Smak
Sukkertøy
Tetthet
1,1132 g / cm3
Smeltepunkt
-12,9 ºC
Kokepunkt
197,3 ºC
Vannløselighet
Blandbar med vann, svært hygroskopisk forbindelse.
Løselighet i andre løsningsmidler
Blandbar med lavere alifatiske alkoholer (metanol og etanol), glyserol, eddiksyre, aceton og lignende ketoner, aldehyder, pyridin, kulltjærebaser og løselig i eter. Praktisk talt uløselig i benzen og dets homologer, klorerte hydrokarboner, petroleumeter og oljer.
antennelsespunkt
111 ºC
Damptetthet
2.14 i forhold til luft tatt som 1.
Damptrykk
0,092 mmHg ved 25 ° C (ved ekstrapolering).
Nedbrytning
Når den varmes opp til nedbrytning, avgir den skarp og irriterende røyk.
Lager temperatur
2-8 ºC
Forbrenningsvarme
1.189,2 kJ / mol
Fordampningsvarme
50,5 kJ / mol
Overflatespenning
47,99 mN / m ved 25 ºC
Brytningsindeks
1,4318 ved 20 ºC
Dissosiasjonskonstant
pKa = 14,22 ved 25 ºC
pH
6 til 7,5 (100 g / l vann) ved 20 ºC
Fordelingskoeffisient for oktanol / vann
Logg P = - 1,69
Kjemisk struktur
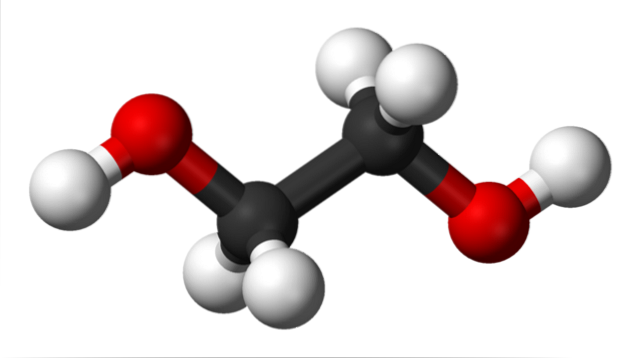
I det øvre bildet har vi etylenglykolmolekylet representert av en modell av kuler og stenger. De svarte kulene tilsvarer karbonatomer som utgjør deres C-C skjelett, og i endene har vi de røde og hvite kulene for henholdsvis oksygen og hydrogenatomer..
Det er et symmetrisk molekyl og ved første øyekast kan det tenkes at det har et permanent dipolmoment; imidlertid roterer deres C-OH-bindinger, noe som favoriserer dipolen. Det er også et dynamisk molekyl som gjennomgår konstante rotasjoner og vibrasjoner, og er i stand til å danne eller motta hydrogenbindinger takket være de to OH-gruppene..
Faktisk er disse interaksjonene ansvarlige for at etylenglykol har så høyt kokepunkt (197 ºC).
Når temperaturen synker til -13 ° C, smelter molekylene sammen i en ortorhombisk krystall, hvor rotamerer spiller en viktig rolle; det vil si at det er molekyler som har O-H-gruppene orientert i forskjellige retninger.
Produksjon
Etylenoksidasjon
Det første trinnet i syntesen av etylenglykol er oksidasjon av etylen til etylenoksid. Tidligere ble etylen omsatt med hypoklorsyre for å produsere klorhydrin. Dette ble deretter behandlet med kalsiumhydroksyd for å produsere etylenoksyd..
Klorohydrinmetoden er ikke veldig lønnsom, og en metode for direkte oksidering av etylen i nærvær av luft eller oksygen ble byttet til ved bruk av sølvoksid som katalysator..
Etylenoksydhydrolyse
Hydrolyse av etylenoksyd (EO) med vann under trykk gir en rå blanding. Vann-glykolblandingen fordampes og resirkuleres, og separerer monoetylenglykol fra dietylenglykol og trietylenglykol ved fraksjonert destillasjon..
Etylenoksydhydrolysereaksjonen kan skisseres som følger:
CtoH4O + HtoO => OH-CHto-CHto-OH (etylenglykol eller monoetylenglykol)
Mitsubishi Chemical utviklet en katalytisk prosess, ved bruk av fosfor, i omdannelsen av etylenoksid til monoetylenglykol.
Omega-prosess
I Omega-prosessen blir etylenoksyd opprinnelig omdannet til etylenkarbonat, gjennom reaksjon med karbondioksid (COto). Deretter underkastes etylenkarbonatet en katalytisk hydrolyse for å oppnå monoetylenglykol med 98% selektivitet..
Det er en relativt ny metode for syntese av etylenglykol. Dette består av oksidativ karbonylering av metanol til dimetyloksalat (DMO) og dens påfølgende hydrogenering til etylenglykol..
applikasjoner
Kjølevæske og frostvæske
Blandingen av etylenglykol med vann tillater en nedgang i frysepunktet og en økning i kokepunktet, slik at bilmotorer ikke fryser om vinteren eller overopphetes om sommeren.
Når prosentandelen etylenglykol i blandingen med vann når 70%, er frysepunktet -55 ° C, slik at etylenglykol-vann-blandingen kan brukes som en kjølevæske, og beskyttelse mot frysing under de forhold der den kan forekomme.
De lave frysetemperaturene til etylenglykolløsninger tillater bruk som frostvæske i bilmotorer; avisning av flyvinger; og i avisingen av frontruten.
Det brukes også til å bevare biologiske prøver som er konservert ved lave temperaturer, og dermed unngå dannelse av krystaller som kan skade prøvenes struktur..
Det høye kokepunktet gjør at etylenglykolløsninger kan brukes til å opprettholde lave temperaturer i enheter eller utstyr som genererer varme under drift, for eksempel: biler, datautstyr, klimaanlegg osv..
Dehydrering
Etylenglykol er en meget hygroskopisk forbindelse som har tillatt bruk for å behandle gasser ekstrahert fra undergrunnen som har høyt innhold av vanndamp. Eliminering av vann fra naturgasser favoriserer effektiv bruk i deres respektive industrielle prosesser..
Polymerproduksjon
Etylenglykol brukes til syntese av polymerer, slik som polyetylenglykol (PEG), polyetylentereftalat (PET) og polyuretan. PEG er en familie av polymerer som brukes i applikasjoner som: matfortykning, forstoppelsesbehandling, kosmetikk, etc..
PET brukes i produksjonen av alle typer engangsbeholdere, som brukes i forskjellige typer drikkevarer og mat. Polyuretan brukes som varmeisolator i kjøleskap og som fyllstoff i forskjellige møbler.
Eksplosiver
Den brukes til fremstilling av dynamitt, slik at den kan lagres med mindre risiko ved å redusere frysepunktet for nitroglyserin..
Trebeskyttelse
Etylenglykol brukes til behandling av tre for å beskytte det mot råte, produsert av sopp. Dette er viktig for bevaring av museumskunstverk.
Andre apper
Etylenglykol er tilstede i medier for å suspendere ledende salter i elektrolytiske kondensatorer og i soyaskumstabilisatorer. Den brukes også til fremstilling av myknere, elastomerer og syntetiske vokser.
Etylenglykol brukes til separering av aromatiske og parafiniske hydrokarboner. I tillegg brukes det til fremstilling av vaskemidler for rengjøringsutstyr. Øker viskositeten og reduserer blekkets flyktighet, noe som gjør det lettere å bruke.
Etylenglykol kan også brukes i støperi av støpesand og som smøremiddel under sliping av glass og sement. Det brukes også som en ingrediens i hydrauliske bremsevæsker og som et mellomprodukt i syntesen av estere, etere, polyesterfibre og harpikser..
Blant harpikser der etylenglykol brukes som råmateriale, er alkyden, brukt som base av alkydmaling, brukt i bil- og arkitektoniske malinger..
Forgiftning og risiko
Symptomer fra eksponering
Etylenglykol har lav akutt toksisitet når det virker ved kontakt med huden eller hvis det inhaleres. Men dets toksisitet manifesteres fullt ut ved inntak, og blir indikert som den dødelige dosen etylenglykol på 1,5 g / kg kroppsvekt, eller 100 ml for en voksen på 70 kg..
Akutt eksponering for etylenglykol gir følgende symptomer: innånding forårsaker hoste, svimmelhet og hodepine. På huden, ved kontakt med etylenglykol, oppstår tørrhet. I mellomtiden produserer det rødhet og smerte i øynene.
Svelging
Svelging av etylenglykol manifesteres av magesmerter, kvalme, bevisstløshet og oppkast. Et overdreven inntak av etylenglykol har en skadelig effekt på sentralnervesystemet (CNS), kardiovaskulær funksjon og nyremorfologi og fysiologi..
På grunn av svikt i funksjonen til CNS, oppstår lammelse eller uregelmessig øyebevegelse (nystagmus). I det kardiopulmonale systemet er det høyt blodtrykk, takykardi og mulig hjertesvikt. Det er alvorlige endringer i nyrene, et resultat av forgiftningen med etylenglykol.
Dilasjon, degenerasjon og kalsiumoksalatavsetning forekommer i nyretubuli. Sistnevnte forklares med følgende mekanisme: etylenglykol metaboliseres av melkesyrehydrogenaseenzymet for å produsere glykoaldehyd.
Glykoaldehyd gir opphav til glykolsyre, glykoksylsyre og oksalsyrer. Oksalsyre utfelles raskt med kalsium for å danne kalsiumoksalat, hvis uoppløselige krystaller avsettes i nyretubuli, noe som gir morfologiske endringer og dysfunksjon i dem, noe som kan føre til nyresvikt..
På grunn av toksisiteten til etylenglykol har den, i noen av dens applikasjoner, gradvis blitt erstattet av propylenglykol.
Økologiske konsekvenser av etylenglykol
Under avisingen frigjør fly betydelige mengder etylenglykol, som ender opp på landingsstrimlene, som når de vaskes får vannet til å overføre etylenglykol gjennom avløpssystemet til elvene der dets toksisitet påvirker levetiden til flyet. fisk.
Men toksisiteten til etylenglykol er ikke i seg selv den viktigste årsaken til økologisk skade. Under den aerobe biologiske nedbrytningen forbrukes en betydelig mengde oksygen som forårsaker reduksjon i overflatevannet.
På den annen side kan dens anaerobe biologiske nedbrytning frigjøre giftige stoffer for fisk, som acetaldehyd, etanol, acetat og metan..
Referanser
- Wikipedia. (2019). Etylenglykol. Gjenopprettet fra: en.wikipedia.org
- Nasjonalt senter for bioteknologisk informasjon. PubChem-database. (2019). 1,2-etandiol. CID = 174. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Artem Cheprasov. (2019). Etylenglykol: struktur, formel og bruksområder. Studere. Gjenopprettet fra: study.com
- Leroy G. Wade. (27. november 2018). Etylenglykol. Encyclopædia Britannica. Gjenopprettet fra: britannica.com
- A. Dominic Fortes og Emmanuelle Suard. (2011). Krystallstrukturer av etylenglykol og etylenglykolmonohydrat. J. Chem. Phys. 135, 234501. doi.org/10.1063/1.3668311
- Icis. (24. desember 2010). Etylenglykol (EG) produksjons- og produksjonsprosess. Gjenopprettet fra: icis.com
- Lucy Bell Young. (2019). Hva er bruken av etylenglykol? ReAgent. Gjenopprettet fra: chemicals.co.uk
- QuimiNet. (2019). Opprinnelse, typer og anvendelser av etylenglykoler. Gjenopprettet fra: quiminet.com
- R. Gomes, R. Liteplo og M.E. Saktmodig. (2002). Etylenglykol: Aspekter for menneskers helse. Verdens helseorganisasjon Genève. [PDF]. Gjenopprettet fra: who.int


Ingen har kommentert denne artikkelen ennå.