
Magnesiumfluoridstruktur, egenskaper, syntese, bruksområder
De magnesiumfluorid det er et fargeløst uorganisk salt hvis kjemiske formel er MgF2. Det finnes i naturen som mineralet sellaitt. Den har et veldig høyt smeltepunkt og er veldig lite løselig i vann. Den er relativt inert, siden reaksjonen med svovelsyre for eksempel er langsom og ufullstendig, og den motstår hydrolyse med flussyre (HF) opp til 750 ° C..
Det er en forbindelse som er lite påvirket av høyenergistråling. I tillegg har den lav brytningsindeks, høy korrosjonsbestandighet, god termisk stabilitet, betydelig hardhet og utmerket synlig, UV (ultrafiolett) og IR (infrarød) lysoverføringsegenskaper..
Disse egenskapene gjør at den har utmerket ytelse i det optiske feltet, og i tillegg gjør det til et nyttig materiale som katalysatorstøtte, beleggingselement, antireflekterende linser og vinduer for infrarød overføring, blant andre applikasjoner..
Artikkelindeks
- 1 Struktur
- 2 eiendommer
- 3 Syntese og forberedelse
- 4 bruksområder
- 4.1 Optikk
- 4.2 Katalyse eller akselerasjon av reaksjoner
- 4.3 Andre bruksområder
- 5 Referanser
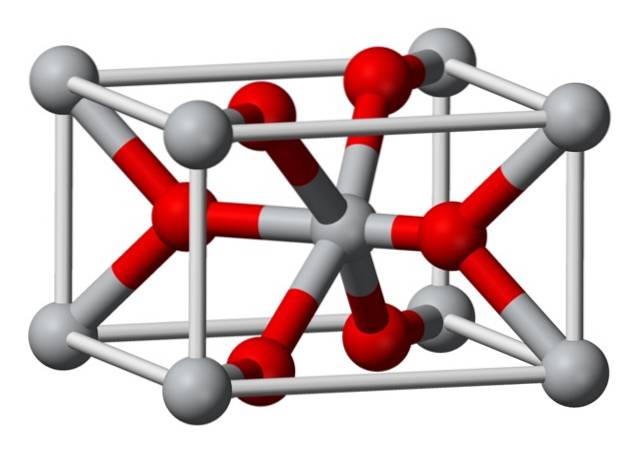
Struktur
Den krystallinske strukturen til kjemisk fremstilt magnesiumfluorid er av samme type som den naturlige mineralet sellaitt. Krystalliserer seg i den dipyramidale klassen i det tetragonale systemet.
Magnesiumioner (Mg2 +) er lokalisert i et sentrert tetragonal gitterrom, mens fluorioner (F-) er funnet i samme plan som og assosiert med deres Mg2 + naboer, gruppert i par med hverandre. Avstanden mellom Mg2 + og F-ionene er 2,07 Å (Ångstrøm) (2,07 × 10-10m).
Krystallkoordinasjonen er 6: 3. Dette betyr at hvert Mg2 + -ion er omgitt av 6 F-ioner, og hvert F-ion er i sin tur omgitt av 3 Mg2 + 5-ioner..
Strukturen er veldig lik den for mineralet rutil, som er den naturlige formen for titandioksid (TiO2), som den har flere krystallografiske egenskaper til felles..
Under produksjonen faller magnesiumfluorid ikke ut som et amorft fast stoff, fordi Mg2 + og F-ionene ikke har en tendens til å danne polymere komplekser i oppløsning..
Eiendommer
Interessant er magnesiumfluorid et dobbeltbrytende materiale. Dette er en optisk egenskap som gjør det mulig å dele en innfallende lysstråle i to separate stråler som forplantes med forskjellige hastigheter og bølgelengder..
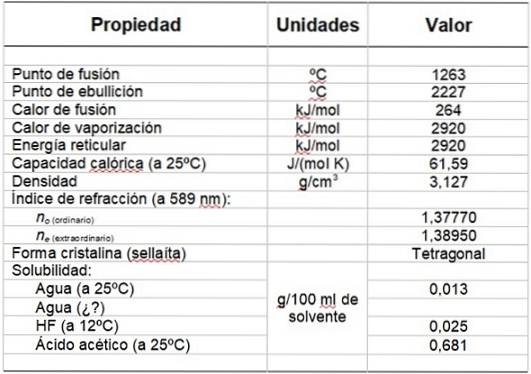
Tabell 1 viser noen av dens egenskaper.
Tabell 1. Fysiske og kjemiske egenskaper til magnesiumfluorid.
Syntese og forberedelse
Den kan tilberedes på forskjellige måter, inkludert følgende:
1-Gjennom reaksjonen mellom magnesiumoksid (MgO) eller magnesiumkarbonat (MgCO3) med flussyre (HF) 2:
MgO + 2 HF MgF2 + H2O
MgCO3 + 2 HF MgF2 + CO2 + H2O
2-ved-reaksjon mellom magnesiumkarbonat og ammoniumbifluorid (NH4HF2), begge i fast tilstand, ved en temperatur mellom 150 og 400 ° C2:
150-400ºC
MgCO3 + NH4HF2 MgF2 + NH3 + CO2 + H2O
3-Oppvarming av en vandig løsning av magnesiumkarbonat og ammoniumfluorid (NH4F) i nærvær av ammoniumhydroksyd (NH4OH) ved 60 ° C 2:
60 ° C, NH4OH
MgCO3 + 3 NH4F NH4MgF3 + (NH4) 2CO3
Det resulterende bunnfallet av magnesiumammoniumfluorid (NH4MgF3) blir deretter oppvarmet til 620 ° C i 4 timer for å oppnå magnesiumfluorid:
620 ºC
NH4MgF3 MgF2 + NH3 + HF
4-Som et biprodukt fra oppnåelse av beryllium (Be) og uran (U). Fluoridet til det ønskede elementet oppvarmes med metallisk magnesium i en digel belagt med MgF2 2:
BeF2 + Mg Be + MgF2
5-reagerende magnesiumklorid (MgCl2) med ammoniumfluorid (NH4F) i vandig løsning ved romtemperatur 3:
25 ° C, H2O
MgCl2 + 2 NH4F MgF2 + 2NH4Cl
Siden metodene for å fremstille MgF2 er dyre, er det forsøk på å oppnå det mer økonomisk, blant hvilke metoden for å produsere den med utgangspunkt i sjøvann skiller seg ut..
Dette kjennetegnes ved å tilsette tilstrekkelig mengde fluorioner (F-) til sjøvann, som har en rikelig konsentrasjon av magnesiumioner (Mg2 +), og favoriserer dermed utfellingen av MgF2..
Optiske magnesiumfluoridkrystaller oppnås ved varmpressing av MgF2-pulver av høy kvalitet, oppnådd for eksempel ved NH4HF2-metoden.
Det er mange teknikker for å fremstille magnesiumfluoridmaterialer, for eksempel enkelkrystallvekst, sintring (komprimering til form eller forming) uten trykk, varmpressing og mikrobølgeovnsintring..
applikasjoner
Optikk
MgF2-krystaller er egnet for optiske applikasjoner fordi de er gjennomsiktige fra UV-regionen til det midtre IR-området 2.10.
Som en inert film brukes den til å endre lysoverføringsegenskapene til optiske og elektroniske materialer. En av hovedapplikasjonene er i VUV-optikk for romforskningsteknologi.
På grunn av sin dobbeltbrytende egenskap er dette materialet nyttig i polarisasjonsoptikk, i vinduer og prismer av Excimer Laser (en type ultrafiolett laser som brukes i øyekirurgi)..
Det skal bemerkes at magnesiumfluoridet som brukes ved fremstilling av tynne filmoptiske materialer, må være fri for urenheter eller forbindelser som er en kilde til oksid, slik som vann (H2O), hydroksidioner (OH-), karbonationer (CO3 = ), sulfationer (SO4 =) og lignende 12.
Katalyse eller akselerasjon av reaksjoner
MgF2 har blitt brukt med suksess som en katalysatorbærer for reaksjonen av eliminering av klor og tilsetning av hydrogen i CFC (klorfluorkarboner), kjente kjølemidler og aerosoldrivmidler, og ansvarlig for skaden på ozonlaget i atmosfæren.
De resulterende forbindelsene, HFC (hydrofluorkarboner) og HCFC (hydroklorfluorkarboner), gir ikke denne skadelige effekten til atmosfæren 5.
Det har også vært nyttig som en katalysatorbærer for hydroavsvovling (fjerning av svovel) av organiske forbindelser..
Andre bruksområder
Materialene generert ved innblanding av grafitt, fluor og MgF2 har høy elektrisk ledningsevne, og det er derfor de er blitt foreslått for bruk i katoder og som elektroledende materialer..
Eutektikken dannet av NaF og MgF2 har energilagringsegenskaper i form av latent varme, og det er derfor den har blitt vurdert for bruk i solenergisystemer..
Innen biokjemi brukes magnesiumfluorid sammen med andre metallfluorider for å hemme fosforyloverføringsreaksjoner i enzymer.
Nylig er MgF2-nanopartikler vellykket testet som medikamentleveringsvektorer i syke celler for behandling av kreft..
Referanser
- Buckley, H.E. og Vernon, W.S. (1925) XCIV. Krystallstrukturen til magnesiumfluorid. Philosophical Magazine Series 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology, bind 11, femte utgave, John Wiley & Sons. ISBN 0-471-52680-0 (v.11).
- Peng, Minhong; Cao, Weiping; og Song, Jinhong. (2015). Fremstilling av MgF2 gjennomsiktig keramikk ved varmpressende sintring. Journal of Wuhan University of Technology-Mater: Sci. Ed. Vol. 30 No. 4.
- Непоклонов, И.С. (2011). Magnesiumfluorid. Kilde: Eget arbeid.
- Wojciechowska, Maria; Zielinski, Michal; og Pietrowski, Mariusz. (2003). MgF2 som en ikke-konvensjonell katalysatorbærer. Journal of Fluorine Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Magnesiumfluorid (MgF2). Hentet 12.07.2019 på: korth.de
- Sevonkaev, Igor og Matijevic, Egon. (2009). Dannelse av magnesiumfluoridpartikler av forskjellige morfologier. Langmuir 2009, 25 (18), 10534-10539.
- Непоклонов, И.С. (2013). Magnesiumfluorid. Kilde: Eget arbeid.
- Tao Qin, Peng Zhang og Weiwei Qin. (2017). En ny metode for å syntetisere billige magnesiumfluoridkuler fra sjøvann. Ceramics International 43 (2017) 14481-14483.
- Ullmann's Encyclopedia of Industrial Chemistry (1996) Femte utgave. Volum A11. VCH Verlagsgesellschaft mbH. New York. ISBN 0-89573-161-4.
- NASA (2013). Ingeniører som inspiserer Hubble-romteleskopets primære speil 8109563. Kilde: mix.msfc.nasa.gov



Ingen har kommentert denne artikkelen ennå.