
Molekylær formel hvordan du får tak i det, eksempler og øvelser
De molekylær formel Det er en representasjon av et molekyl av en forbindelse, der atomene til alle elementene som er tilstede i forbindelsen og deres antall er indikert av deres kjemiske symboler. Hvert atom er ledsaget av et underskrift.
Molekylformelen har begrensningen at den ikke indikerer bindingene til de forskjellige atomene i molekylet, og heller ikke deres romlige forhold; som strukturformelen gjør. I noen tilfeller er det ikke spesifikt, for eksempel: C6H12ELLER6 er molekylformelen glukose, galaktose og fruktose.
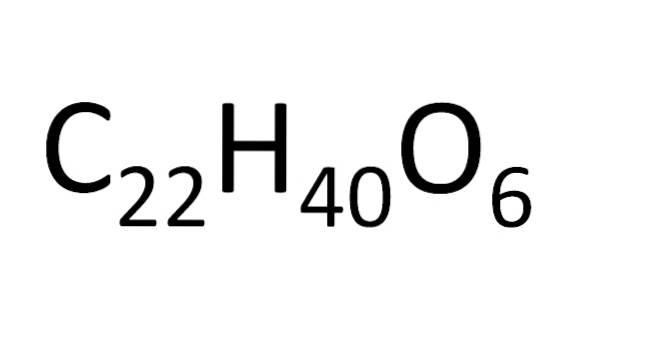
Det er et sett med regler for arrangement av atomer i en molekylformel. For ioniske salter, for eksempel natriumklorid, er kation-symbolet (Na+) og deretter anion-symbolet (Cl-). Dette er grunnen til at molekylformelen av natriumklorid er NaCl.
Molekylformelen til organiske forbindelser skrives ved å plassere symbolet for karbon (C) først, etterfulgt av symbolet for hydrogen (H), og deretter de gjenværende atomene. For eksempel er molekylformelen av eddiksyre CtoH4ELLERto.
Artikkelindeks
- 1 Hvordan få molekylformelen
- 1.1 Første trinn
- 1.2 Andre trinn
- 1.3 Tredje trinn
- 1.4 Fjerde trinn
- 1.5 Femte trinn
- 2 Eksempler på molekylformler
- 3 Løst øvelser
- 3.1 - Øvelse 1
- 3.2 - Øvelse 2
- 4 Referanser
Hvordan få molekylformelen
Å skaffe molekylformelen til en forbindelse er basert på tidligere etablering av dens minimums- eller empiriske formel. Av denne grunn er de første trinnene for å oppnå begge formlene vanlige..
Første skritt
Det er vanlig å uttrykke massen av elementene i en kjemisk forbindelse i prosentform. En enkel beregning må deretter utføres for å transformere masseprosentene til de forskjellige elementene til massene uttrykt i gram..
Andre trinn
Å kjenne massen i gram av hvert av elementene, og deres atommasse, det relative antallet av hvert atom eller antall mol av hvert atom kan oppnås ved å dele massen til hvert av de forskjellige elementene med deres atommasse..
Tredje trinn
Del det relative antallet alle sammen atomer, skriv inn det relative antallet med mindre verdi. Verdiene til minimumsandelen må være hele tall. I tilfelle at en verdi av andelen inneholder en desimal, må det gjøres en korreksjon for å få den desimalen til å forsvinne.
Korreksjonen består i å multiplisere alle verdiene til andelen med et tall som returnerer heltall til alle verdiene. For eksempel, hvis en verdi av minimumsandelen er 1,25, må alle verdiene multipliseres med fire (4). Siden 1,25 ganger 4 er lik 5, et helt tall.
Fjerde trinn
Alle de kjemiske symbolene til elementene i forbindelsen blir plassert og med tilhørende abonnement; det vil si verdien av den minste andelen av elementet.
Femte trinn
Minimumsformelen til en forbindelse kan transformeres til dens molekylformel ved å oppnå forholdet mellom molekylvekten til forbindelsen og vekten av dens minimumsformel (n). Dette forholdet er det samme som eksisterer mellom molekylformelen og minimumsformelen.
n = molekylvekt av forbindelse / vekt med minimumsformel
For å oppnå molekylformelen må minimumsformelen multipliseres med n. Dette innebærer at hvert abonnement med minimumsformelen må multipliseres med n.
n = Molekylvekt / Minimum formelvekt
= Molekylformel / Minimumformel
Molekylær formel = n minimum formel
Eksempler på molekylære formler
Noen vanlige molekylære formler er oppført nedenfor:
-Jernoksid (FeO)
-Natriumhydroksid (NaOH)
-Kaliumoksid (KtoELLER)
-Kloroksyd (CltoELLER7)
-Ferrohydroksid [Fe (OH)3]
-Kalsiumklorid (CaClto)
-Saltsyre (HCl)
-Natriumsulfat (NtoSW4)
-Svovelsyre (HtoSW4)
-Perbromsyre (HBrO4)
-Aluminiumklorid (AlCl3)
-Metan (CH4)
-Propan (C3H8)
-Etan (CtoH6)
-Etylalkohol (CtoH6ELLER)
-Eddiksyre (CtoH4ELLERto)
-Benzen (C6H6)
-Glukose (C6H12ELLER6)
Løst øvelser
- Øvelse 1
Metylbenzoat har følgende masseprosenter:
C: 70,57%,
H: 5,93%
Eller: 23,49%
Og en molekylvekt på 136,1 g / mol. Bestem molekylformelen.
Første skritt
Det første trinnet er å uttrykke masseprosentene av elementene i massene i gram, vel vitende om at masseprosentene er i forhold til molekylvekten..
Av de 136,1 gram som tilsvarer molen av forbindelsen, representerer 70,57% bare karbon. Og så videre med de gjenværende elementene:
Karbonmasse = 136,1 g (70,57 / 100)
= 96,05 g
Masse av hydrogen = 136,1 g (5,93 / 100)
= 8,06 g
Masse oksygen = 136,1 (23,49 / 100)
= 31,96 g
Andre trinn
Ved utarbeidelsen av molekylformelen må det relative antallet atomer (NRA) bestemmes. For å gjøre dette deles massene av elementene av deres atommasser:
NRA (C) = 96 g / 12 g
= 8
NRA (H) = 8 g / 1 g
= 8 g
NRA (O) = 32 g / 16 g
= 2
Tredje trinn
Vi må da beregne elementets minste andeler (PME). For å gjøre dette deles alle NRA-verdiene med den laveste NRA-verdien:
PME (C) = 8/2
= 4
PME (H) = 8/2
= 4
PME (O) = 2/2
= 1
Fjerde trinn
Skriv minimumsformelen for metylbenzoat, basert på det faktum at abonnementene til elementene er deres beregnede minste proporsjoner:
C4H4ELLER
Femte trinn
Til slutt må molekylformelen av metylbenzoat etableres. Vi beregner derfor n:
n = molekylvekt / minimum formelvekt
Vekten av minimumsformelen er 68 g / mol:
= 136,1 g / 68 g
n ≈ 2
Molekylformel = 2minimumsformel
= 2 C4H4ELLER
Molekylformel av metylbenzoat = C8H8ELLERto
- Øvelse 2
Prosentandelen av elementene som utgjør benzen er som følger:
C: 92,36%
H: 7,64%.
Molekylvekten til benzen er 78 g / mol. Bestem molekylformelen din.
Første skritt
Forvandle masseprosentene til elementene til massene i gram:
Karbonmasse = 78 g (92,36 / 100)
= 72,04 g
Masse av hydrogen = 78 g (7,64 / 100)
= 5,96 g
Andre trinn
Beregning av det relative antall atomer (NRA). For å gjøre dette deles massene av elementene av deres atommasser:
NRA (C) = 72 g / 12 g
= 6
NRA (H) = 6 g / 1 g
= 6
Tredje trinn
Beregning av verdiene til minimumsandelen av elementene (PME). Dette beregnes ved å dele NRA-verdiene til alle elementene med den minste NRA-verdien:
PME (C) = 6/6
= 1
PME (H) = 6/6
= 1
Fjerde trinn
Å skrive minimumsformelen for benzen, med tanke på at abonnementene til elementene er verdiene til minimumsandelen beregnet.
Minimum benzenformel: CH
Femte trinn
Etablering av molekylformelen ved å beregne forholdet mellom molekylmassen og massen til minimumsformelen:
n = Molekylvekt / vekt av minimumsformelen
= 78 g / 13 g
n = 6
Molekylformel = minimum formel
= 6CH
= C6H6
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Wikipedia. (2020). Kjemisk formel. Gjenopprettet fra: en.wikipedia.org
- Grenseløs læring. (s.f.). Molekylære formler. Gjenopprettet fra: courses.lumenlearning.com
- Helmenstine, Anne Marie, Ph.D. (29. september 2019). Beregn empiriske og molekylære formler. Gjenopprettet fra: thoughtco.com
- Peter J. Mikulecky, Chris Hren. (2020). Hvordan bruke empiriske formler for å finne molekylære formler. Gjenopprettet fra: dummies.com



Ingen har kommentert denne artikkelen ennå.