
Gasser egenskaper, oppførsel, form, eksempler

De gasser De er alle de stoffene eller forbindelsene hvis aggregeringstilstander er svake og spredte, samtidig som de er avhengige av trykk- og temperaturforholdene som styrer dem. De er kanskje den nest mest utbredte formen for materie i hele universet etter plasma..
På jorden utgjør gasser lagene i atmosfæren, fra eksosfæren til troposfæren og luften vi puster inn. Selv om en gass er usynlig når den diffunderer gjennom store rom, for eksempel himmelen, oppdages den av bevegelse av skyer, svingene til en kvernes blader eller av dampene som pustes ut fra munnen vår i kaldt klima..

Når det gjelder negative miljøaspekter, observeres det i den svarte røyken fra eksosrørene til kjøretøyene, i røyksøylene til tårnene i fabrikkene, eller i røyken som heves når en skog brenner.
Du møter også gassfenomener når du ser damp som kommer ut av kloakken, i sumpene på sumpene og kirkegårdene, i boblingen inne i fisketankene, i heliumballongene som slippes ut i himmelen, i oksygenet som frigjøres av planter som et resultat av fotosyntesen, og til og med ved raping og oppblåsthet.
Uansett hvor gasser blir observert, betyr det at det skjedde en kjemisk reaksjon, med mindre de er fiksert eller assimilert direkte fra luften, den viktigste gasskilden (overfladisk) på planeten. Når temperaturen stiger, vil alle stoffer (kjemiske elementer) forvandles til gasser, inkludert metaller som jern, gull og sølv..
Uavhengig av den kjemiske naturen til gasser, deler de alle felles den store avstanden som skiller partiklene deres (atomer, molekyler, ioner osv.), Som beveger seg kaotisk og vilkårlig gjennom et gitt volum eller rom..
Artikkelindeks
- 1 Gassegenskaper
- 1.1 Fysisk
- 1.2 Elektrisk og termisk ledningsevne
- 1.3 Reaktivitet
- 2 Oppførsel av gasser
- 3 Gassform
- 4 Trykk på en gass
- 4.1 Enheter
- 5 Volum av en gass
- 6 Hovedgasslover
- 6.1 Boyles lov
- 6.2 Charles Law
- 6.3 Gay-Lussacs lov
- 6.4 Avogadros lov
- 7 Typer gasser
- 7.1 Brennbare gasser
- 7.2 Industrigasser
- 7.3 Inerte gasser
- 8 Eksempler på gassformede stoffer og forbindelser
- 8.1 Gassformige forbindelser
- 9 Referanser
Egenskaper av gasser
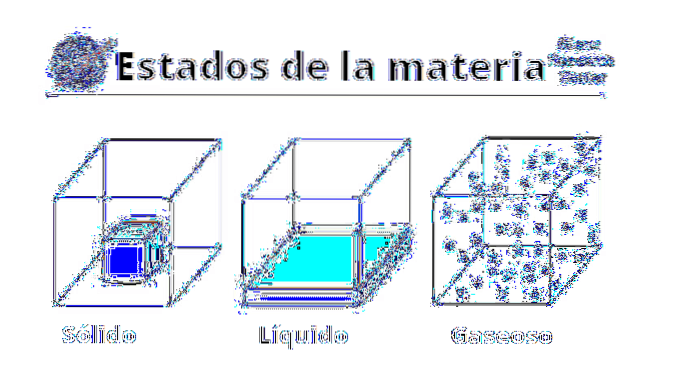
Fysisk
De fysiske egenskapene til gasser varierer avhengig av hvilket stoff eller en forbindelse som er involvert. Gasser er populært forbundet med dårlig lukt eller forråtnelse, enten på grunn av svovelinnholdet, eller tilstedeværelsen av flyktige aminer. På samme måte blir de visualisert med grønnaktig, brun eller gulaktig fargestoffer, som skremmer og gir et dårlig varsel.
Imidlertid er de fleste gasser, eller i det minste de rikeligste, faktisk fargeløse og luktfrie. Selv om de er unnvikende, kan de føles på huden, og de motstår bevegelse, og til og med skaper tyktflytende lag på kroppene som passerer gjennom dem (som det skjer med fly)..
Alle gasser kan gjennomgå trykk- eller temperaturendringer som til slutt forvandler dem til deres respektive væsker; det vil si at de lider av kondens (hvis de blir avkjølt) eller kondensering (hvis de blir "presset").

På den annen side er gasser i stand til å oppløses i væsker og noen porøse faste stoffer (for eksempel aktivt karbon). Boblene er resultatet av akkumuleringer av gasser som ennå ikke har løst seg opp i mediet og rømmer mot overflaten av væsken..
Elektrisk og termisk ledningsevne
Under normale forhold (uten ionisering av partiklene) er gasser dårlige ledere av varme og elektrisitet. Imidlertid når de er stresset med mange elektroner, tillater de strøm å passere gjennom dem, sett i lyn under stormer..
På den annen side, ved lave trykk og utsatt for et elektrisk felt, lyser noen gasser, spesielt de edle eller perfekte, og lysene deres brukes til design av reklame og nattplakater (neonlys), så vel som i berømte elektriske utladningslamper i gatelykt.
Når det gjelder varmeledningsevne, oppfører mange gasser seg som varmeisolatorer, så deres innlemmelse i fylling av fibre, tekstiler eller glasspaneler bidrar til å forhindre at varmen går gjennom dem og holder temperaturen konstant..
Imidlertid er det gasser som er gode varmeledere, og som kan forårsake verre forbrenninger enn de som er forårsaket av væsker eller faste stoffer; for eksempel som med varm damp fra bakte cupcakes (eller empanadas), eller fra dampstråler som rømmer fra kjeler.
Reaktivitet
Generelt er reaksjoner som involverer gasser, eller hvor de oppstår, klassifisert som farlige og tungvint.
Reaktiviteten deres avhenger igjen av deres kjemiske natur; Imidlertid må større forsiktighet og kontroll utvises når de utvides og mobiliseres med stor letthet fordi de kan utløse drastiske trykkøkninger som setter reaktorstrukturen i fare; for ikke å nevne hvor brannfarlige eller ikke lykksalige gasser er.
Oppførsel av gasser
Makroskopisk kan man få et inntrykk av gassens oppførsel ved å være vitne til hvordan røyk, ringer eller de litterære "tungene" til sigaretter utvikler seg i luften. På samme måte, når en røykgranat eksploderer, er det interessant å detaljere bevegelsen til disse forskjellige fargede skyene.
Imidlertid er slike observasjoner utsatt for luftens virkning, og også for det faktum at det er veldig fine faste partikler suspendert i røyken. Derfor er disse eksemplene ikke nok til å komme til en konklusjon angående gassens virkelige oppførsel. I stedet er det utført eksperimenter og den kinetiske teorien om gasser er utviklet..
Molekylært og ideelt kolliderer gassformige partikler elastisk med hverandre med lineære, rotasjons- og vibrasjonsforskyvninger. De har en tilhørende gjennomsnittsenergi, som gjør at de kan reise fritt gjennom ethvert rom uten å nesten samhandle eller kollidere med en annen partikkel når volumet rundt dem øker..
Hans oppførsel ville bli en blanding av den uberegnelige Brown-bevegelsen, og kollisjonene til noen biljardkuler som spretter ustanselig mellom hverandre og veggene på bordet; hvis det ikke er noen vegger, vil de diffundere mot uendelig, med mindre de holdes tilbake av en kraft: tyngdekraften.
Gassform
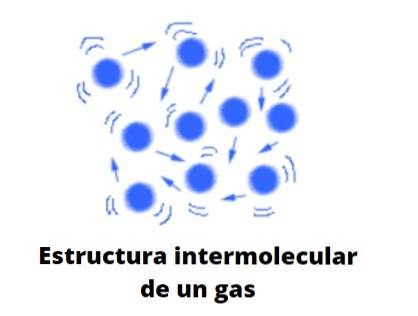
Gasser, i motsetning til væsker og faste stoffer, er ikke av kondensert type. det vil si at aggregering eller kohesjon av partiklene aldri klarer å definere en form. De deler med væsker det faktum at de helt opptar volumet av beholderen som inneholder dem; de mangler imidlertid overflatespenning og overflatespenning.
Hvis gasskonsentrasjonen er høy, kan dens “tunger” eller de allerede beskrevne makroskopiske formene sees med det blotte øye. Disse vil før eller senere ende opp med å forsvinne ved å påvirke vinden eller bare ved å utvide gassen. Gassene dekker derfor alle hjørnene i det begrensede rommet som stammer fra svært homogene systemer.
Nå vurderer teorien gasser som kugler som knapt kolliderer med seg selv; men når de gjør det, spretter de elastisk.
Disse kulene er vidt skilt fra hverandre, så gassene er praktisk talt "fulle" av vakuum; derav allsidigheten til å passere gjennom den minste spalten eller sprekken, og den enkle å kunne komprimere dem betydelig.
Det er derfor, uansett hvor lukket et bakeriinstallasjon er, hvis du går ved siden av det, er det sikkert at du vil nyte aromaen av nybakte brød..
Trykk på en gass
Man kan tro at fordi kulene eller partiklene i gassen er spredt og separert slik, er de ikke i stand til å generere noe trykk på legemene eller gjenstandene. Atmosfæren viser imidlertid at en slik tro er falsk: den har masse, vekt og hindrer væsker i å fordampe eller koke ut fra ingensteds. Kokepunkter måles ved atmosfærisk trykk.
Gasstrykk blir mer kvantifiserbare hvis manometre er tilgjengelige, eller hvis de er lukket i containere med ikke-deformerbare vegger. Dermed, jo flere gasspartikler det er inne i beholderen, jo større antall kollisjoner mellom dem og veggene i beholderen..
Når de kolliderer med veggene, presser disse partiklene dem, siden de utøver en kraft proporsjonal med deres kinetiske energi på overflaten. Det er som om de ideelle biljardkulene ble kastet mot en vegg; hvis det er mange som påvirker dem i høy hastighet, kan det til og med gå i stykker.
Enheter
Det er mange enheter som følger gasstrykkmålinger. Noen av de mest kjente er millimeter kvikksølv (mmHg), som torr. Det er de fra det internasjonale enhetssystemet (SI) som definerer pascal (Pa) når det gjelder N / mto; og av ham kilo (kPa), mega (MPa) og giga (GPa) pascal.
Volum av en gass
En gass okkuperer og utvider seg gjennom hele beholderens volum. Jo større beholderen er, vil volumet av gassen være for; men både trykk og tetthet vil reduseres for samme mengde partikler.
Gassen selv har derimot et tilhørende volum som ikke avhenger så mye av dens natur eller molekylære struktur (ideelt sett), men av trykk- og temperaturforholdene som styrer den; dette er dens molare volum.
I virkeligheten varierer molarvolumet fra en gass til en annen, selv om variasjonene er små hvis de ikke er store og heterogene molekyler. For eksempel molarvolumet av ammoniakk (NH3, 22 079 L / mol) ved 0 ºC og 1 atm, skiller seg fra helium (He, 22 435 L / mol).
Alle gasser har et molarvolum som endres som en funksjon av P og T, og uansett hvor store partiklene deres er, er antallet av dem alltid det samme. Herfra avledet han faktisk det som er kjent med Avogadros nummer (NTIL).
Hovedgasslover
Oppførselen til gasser har blitt studert i århundrer gjennom eksperimenter, grundige observasjoner og tolkning av resultatene..
Slike eksperimenter gjorde det mulig å etablere en rekke lover som, satt sammen i den samme ligningen (den for ideelle gasser), hjelper til med å forutsi responsene til en gass til forskjellige forhold for trykk og temperatur. På denne måten er det et forhold mellom volum, temperatur og trykk, samt antall mol i et gitt system..
Blant disse lovene er følgende fire: Boyle, Charles, Gay-Lussac og Avogadro's.
Boyles lov
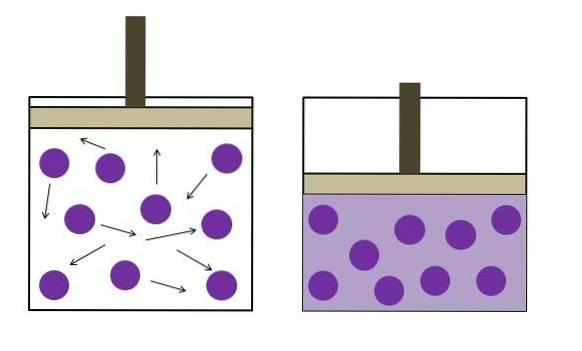
Boyles lov sier at volumet av en ideell gass ved konstant temperatur er omvendt proporsjonalt med trykket; jo større beholderen er, desto lavere trykk vil veggene oppleve på grunn av samme mengde gass..
Charles Law

Charles lov sier at volumet av en ideell gass ved konstant trykk er direkte proporsjonal med temperaturen. Ballonger demonstrerer Charles lov, fordi hvis de blir oppvarmet, blåser de opp litt mer, mens hvis de er nedsenket i flytende nitrogen, tømmes de fordi gassvolumet i dem trekker seg sammen..
Gay-Lussac-lov
Gay-Lussacs lov sier at trykket til en ideell gass ved konstant volum er direkte proporsjonalt med temperaturen. I en godt lukket gryte, hvis en gass varmes opp gradvis, vil trykket inni den være større, fordi veggene i gryten ikke deformeres eller utvides; det vil si at volumet ikke endres, det er konstant.
Avogadros lov
Til slutt sier Avogadros lov at volumet okkupert av en ideell gass er direkte proporsjonalt med antall partikler. Dermed, hvis vi har en mol partikler (6.02 · 102. 3), vil vi da ha molarvolumet til gassen.
Typer gasser
Brennbare gasser
De er de gassene hvis komponenter fungerer som drivstoff, fordi de brukes til produksjon av termisk energi. Noen av dem er naturgass, flytende petroleumsgass og hydrogen.
Industrigasser
Det er de produserte gassene, som markedsføres til publikum for forskjellige bruksområder og bruksområder, for eksempel for helse-, mat-, miljøvern, metallurgi, kjemisk industri, sikkerhetssektorer, blant andre. Noen av disse gassene er blant annet oksygen, nitrogen, helium, klor, hydrogen, karbonmonoksid, propan, metan, lystgass..
Inerte gasser
Det er de gassene som under spesifikke temperatur- og trykkforhold ikke genererer noen kjemisk reaksjon eller veldig lav. De er neon, argon, helium, krypton og xenon. De brukes i kjemiske prosesser der ikke-reaktive elementer er nødvendige.
Eksempler på gassformede stoffer og forbindelser
Hva er gasselementene i det periodiske systemet under jordforhold?
Vi har først hydrogen (H), som danner H-molekylerto. Helium (He), den letteste edelgassen, følger; og deretter nitrogen (N), oksygen (O) og fluor (F). Disse tre siste danner også diatomiske molekyler: Nto, ELLERto og Fto.
Etter fluor kommer neon (Ne), edelgassen som følger helium. Under fluor har vi klor (Cl), i form av Cl-molekylerto.
Deretter har vi resten av edelgassene: argon (Ar), krypton (Kr), xenon (Xe), radon (Rn) og oganeson (Og).
Derfor er de totalt tolv gassformede elementer; elleve hvis vi ekskluderer den svært radioaktive og ustabile oganeson.
Gassformige forbindelser
I tillegg til gasselementer vil noen vanlige gassforbindelser bli oppført:
-HtoJa, hydrogensulfid, ansvarlig for lukten av råtne egg
-NH3, ammoniakk, den skarpe aromaen som finnes i brukte såper
-COto, karbondioksid, en klimagass
-IKKEto, nitrogendioksid
-NO, nitrogenmonoksid, en gass som ble antatt å være svært giftig, men som spiller en viktig rolle i sirkulasjonssystemet
-SW3, svoveltrioksid
-C4H10, butan
-HCl, hydrogenklorid
-ELLER3, ozon
-SF6, svovelheksafluorid
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Egenskapene til gasser. Gjenopprettet fra: chemed.chem.purdue.edu
- Wikipedia. (2019). Gass. Gjenopprettet fra: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (5. desember 2018). Gasser - Generelle egenskaper for gasser. Gjenopprettet fra: thoughtco.com
- Harvard Men's Health Watch. (2019). Gasstilstanden. Gjenopprettet fra: health.harvard.edu
- Elektronikk kjøleredaktører. (1. september 1998). Gassens varmeledningsevne. Gjenopprettet fra: electronics-cooling.com



Ingen har kommentert denne artikkelen ennå.