
Karbonylgruppeegenskaper, egenskaper, nomenklatur, reaktivitet
De karbonylgruppe Det er en organisk og oksygenert funksjonell gruppe som ligner det gassformige karbonmonoksydmolekylet. Det er representert som C = O, og selv om det regnes som organisk, kan det også finnes i uorganiske forbindelser; som karbonsyre, HtoCO3, eller i organometalliske forbindelser med CO som bindemiddel.
Imidlertid er det i kjemien til karbon, liv, biokjemi og andre lignende vitenskapelige grener der denne gruppen skiller seg ut for sin enorme betydning. Hvis det ikke var for ham, ville mange molekyler ikke være i stand til å samhandle med vann; proteiner, sukker, aminosyrer, fett, nukleinsyrer og andre biomolekyler ville ikke eksistere hvis det ikke var for ham.
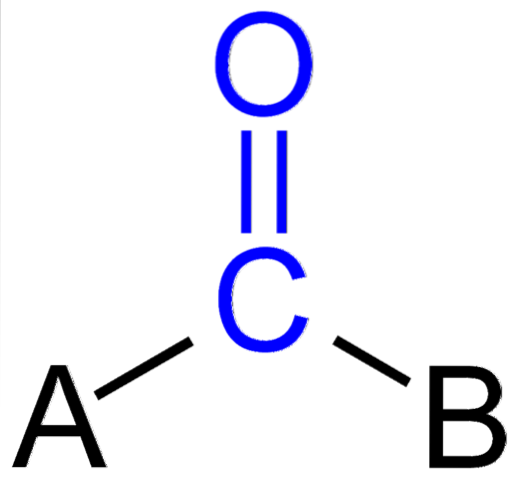
Bildet over viser hvordan denne gruppen ser ut i det generelle skjelettet til en forbindelse. Merk at den er fremhevet av den blå fargen, og hvis vi fjerner substituentene A og B (R eller R ', like gyldige), vil et karbonmonoksidmolekyl forbli. Tilstedeværelsen av disse substituentene definerer et stort antall organiske molekyler.
Hvis A og B er andre atomer enn karbon, slik som metaller eller ikke-metalliske elementer, kan man ha henholdsvis organometalliske eller uorganiske forbindelser. Når det gjelder organisk kjemi, vil substituentene A og B alltid være enten hydrogenatomer, karbonkjeder, linjer, med eller uten forgreninger, sykliske eller aromatiske ringer..
Slik begynner det å forstå hvorfor karbonylgruppen er ganske vanlig for de som studerer naturvitenskap eller helsevitenskap; den er overalt, og uten den ville de molekylære mekanismene som skjer i cellene våre ikke forekomme.
Hvis dets relevans kunne oppsummeres, ville det sies at det bidrar med polaritet, surhet og reaktivitet til et molekyl. Der det er en karbonylgruppe, er det mer enn sannsynlig at akkurat på det tidspunktet kan molekylet gjennomgå en transformasjon. Derfor er det et strategisk sted å utvikle organisk syntese gjennom oksidasjon eller nukleofile angrep..
Artikkelindeks
- 1 Karakteristika og egenskaper for karbonylgruppen
- 1.1 Resonansstrukturer
- 2 Nomenklatur
- 3 Reaktivitet
- 3.1 Nukleofilt angrep
- 3.2 Reduksjon
- 3.3 Dannelse av acetaler og ketaler
- 4 typer
- 5 Hvordan identifisere det i aldehyder og ketoner
- 5.1 Identifikasjon
- 6 Hovedeksempler
- 7 Referanser
Karakteristika og egenskaper for karbonylgruppen
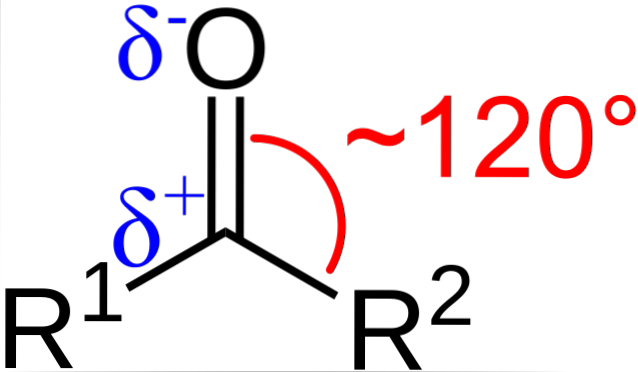
Hva er de strukturelle og elektroniske egenskapene til karbonylgruppen? Ovenfor kan du se, nå med bokstavene R1 og Rto i stedet for A og B er det en vinkel på 120 ° C mellom substituentene og oksygenatomet; det vil si geometrien rundt denne gruppen er et trigonalplan.
For at slik geometri skal være karbon- og oksygenatomer, må de nødvendigvis ha kjemisk hybridiseringto; dermed vil karbon ha tre sp-orbitalerto for å danne enkle kovalente bindinger med R1 og Rto, og en bane s ren for å etablere dobbeltbinding med oksygen.
Dette forklarer hvordan det kan være en C = O dobbeltbinding.
Hvis bildet observeres, vil det også sees at oksygen har en høyere elektrontetthet, δ-, enn karbon, δ +. Dette skyldes det faktum at oksygen er mer elektronegativt enn karbon, og derfor "frarøver" det elektrontettheten; og ikke bare ham, men også R-substituentene1 og Rto.
Følgelig genereres et permanent dipolmoment som kan være av større eller mindre størrelse avhengig av molekylær struktur. Uansett hvor det er en karbonylgruppe, vil det være dipolmomenter.
Resonansstrukturer
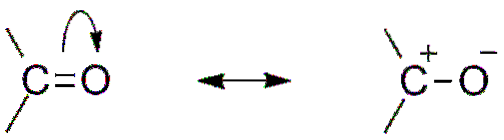
En annen konsekvens av elektronegativiteten til oksygen er at det i karbonylgruppen er resonansstrukturer som definerer en hybrid (kombinasjonen av de to strukturene i det øvre bildet). Merk at elektronparet kan vandre mot bane s oksygen, som etterlater karbonatomet med en positiv delvis ladning; en carbocation.
Begge strukturer etterfølger konstant hverandre, så karbon opprettholder en konstant mangel på elektroner; det vil si at for kationer som er veldig nær det, vil de oppleve elektrostatisk frastøting. Men hvis det er et anion, eller en art som er i stand til å donere elektroner, vil du føle en sterk tiltrekningskraft for dette karbonet..
Så skjer det som er kjent som det nukleofile angrepet, som vil bli forklart i en fremtidig seksjon.
Nomenklatur
Når en forbindelse har gruppen C = O, sies det å være karbonyl. Avhengig av karbonylforbindelsens natur har den således sine egne nomenklaturregler.
Selv om de uansett hva det er, har de en felles regel: C = O har prioritet i karbonkjeden når de lister karbonatomer.
Dette betyr at hvis det er grener, halogenatomer, nitrogenholdige funksjonelle grupper, dobbelt- eller trippelbindinger, kan ingen av dem ha et lokaliseringsnummer mindre enn C = O; derfor begynner den lengste kjeden å bli oppført så nær karbonylgruppen som mulig.
Hvis det derimot er flere C = O'er i kjeden, og en av dem er en del av en høyere funksjonell gruppe, vil karbonylgruppen ha en større lokalisator og vil bli nevnt som en oksosubstituent..
Og hva er dette hierarkiet? Følgende, fra høyeste til laveste:
-Karboksylsyrer, RCOOH
-Ester, RCOOR '
-Amida, RCONHto
-Aldehyd, RCOH (eller RCHO)
-Keton, RCOR
Ved å erstatte R og R 'for molekylære segmenter har et utall karbonylforbindelser stammer fra familiene ovenfor: karboksylsyrer, estere, amider, etc. Hver og en har sin tradisjonelle eller IUPAC-nomenklatur knyttet til seg..
Reaktivitet
Nukleofilt angrep
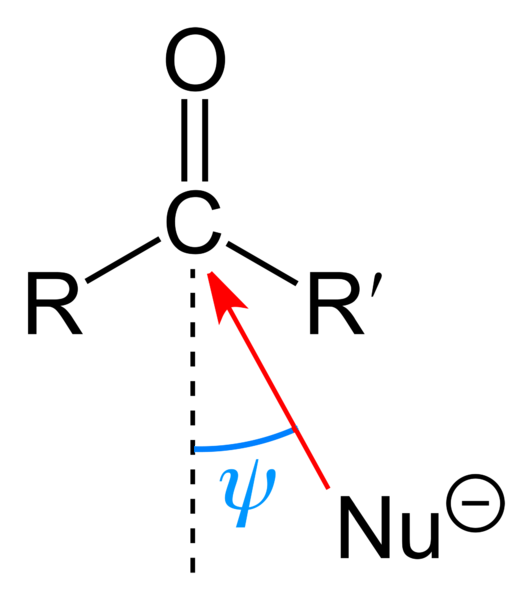
Det øvre bildet viser det nukleofile angrepet som lider av karbonylgruppen. Nukleofilen, Nu-, det kan være et anion eller en nøytral art med tilgjengelige elektronpar; som ammoniakk, NH3, for eksempel. Det ser utelukkende etter karbon fordi det ifølge resonansstrukturer har en positiv delvis ladning.
Positiv ladning tiltrekker Nu-, som vil søke å tilnærme seg med en "flanke" slik at det er minst sterisk hindring fra R- og R'-substituentene. Avhengig av hvor omfangsrike de er, eller størrelsen på Nu-, angrepet vil skje i forskjellige vinkler ψ; kan være veldig åpen eller lukket.
Når angrepet har skjedd, vil det dannes en mellomforbindelse, Nu-CRR'-O-; det vil si at oksygen er igjen med et par elektroner slik at Nu kan tilsettes- karbonylgruppe.
Dette negativt ladede oksygenet kan gripe inn i andre trinn i reaksjonen; protonert som en hydroksylgruppe, OH, eller frigitt som et vannmolekyl.
De involverte mekanismene, så vel som reaksjonsproduktene som oppnås ved dette angrepet, er veldig varierte..
Derivater
Det nukleofile midlet Nu- det kan være mange arter. Spesielt for hver enkelt, når de reagerer med karbonylgruppen, stammer forskjellige derivater.
For eksempel, når nevnte nukleofile middel er et amin, NHtoR, imines stammer, RtoC = NR; hvis det er hydroksylamin, NHtoOH, gir oksimer, RR'C = NOH; hvis det er cyanidanionet, CN-, cyanohydriner produseres, RR'C (OH) CN, og så videre med andre arter.
Reduksjon
Først ble det sagt at denne gruppen er oksygenert og derfor oksidert. Dette betyr at det, gitt forholdene, kan reduseres eller miste bånd med oksygenatomet ved å erstatte det med hydrogener. For eksempel:
C = O => CHto
Denne transformasjonen indikerer at karbonylgruppen ble redusert til en metylengruppe; det var en gevinst av hydrogen som et resultat av tap av oksygen. I mer passende kjemiske termer: karbonylforbindelsen reduseres til en alkan.
Hvis det er et keton, RCOR ', i nærvær av hydrazin, HtoN-NHto, og et sterkt basisk medium kan reduseres til dets respektive alkan; Denne reaksjonen er kjent som Wolff-Kishner reduksjon:
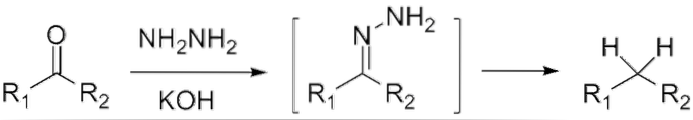
Hvis reaksjonsblandingen derimot består av sammensmeltet sink og saltsyre, er reaksjonen kjent som Clemmensen reduksjon:
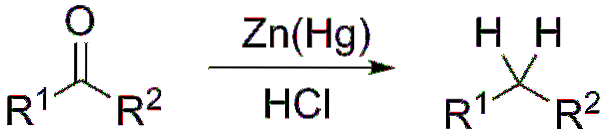
Dannelse av acetaler og ketaler
Karbonylgruppen kan ikke bare tilsette nukleofile midler Nu-, men under sure forhold kan den også reagere med alkoholer gjennom lignende mekanismer.
Når et aldehyd eller keton delvis reagerer med en alkohol, blir det produsert hemiacetaler eller hemicetals. Hvis reaksjonen er fullført, er produktene acetaler og ketaler. Følgende kjemiske ligninger oppsummerer og klargjør det som nettopp er nevnt:
RCHO + R3OH g RCHOH (OR3) (Hemiacetal) + R4OH g RCH (OR3) (ELLER4) (Acetal)
RCORto + R3OH g RCORto(OH) (ELLER3) (Hemiketal) + R4OH g RCORto(ELLER3) (ELLER4) (ketal)
Den første reaksjonen tilsvarer dannelsen av hemiacetaler og acetaler fra et aldehyd, og den andre av hemicetaler og ketaler fra et keton.
Disse ligningene er kanskje ikke enkle nok til å forklare dannelsen av disse forbindelsene; For en første tilnærming til emnet er det imidlertid nok å forstå at alkoholer tilsettes, og at sidekjedene R (R3 og R4) blir bundet til karbonylkarbon. Det er derfor OR blir lagt til3 og OR4 til det opprinnelige molekylet.
Hovedforskjellen mellom en acetal og en ketal er tilstedeværelsen av hydrogenatomet bundet til karbonet. Merk at ketonen mangler dette hydrogenet.
Typer
Svært lik som forklart i nomenklaturdelen for karbonylgruppen, dens typer er en funksjon som er substituentene A og B, eller R og R '. Derfor er det strukturelle egenskaper som deler en serie karbonylforbindelser utover bare rekkefølgen eller typen bindinger..
For eksempel ble nevnt i begynnelsen av analogien mellom denne gruppen og karbonmonoksid, C20. Hvis molekylet er blottet for hydrogenatomer, og hvis det også er to terminale C = O, vil det være et karbonoksid, CnELLERto. For n lik 3, vil vi ha:
O = C = C = C = O
Som er som om det var to C20-molekyler sammenføyd og separert av et karbon.
Karbonylforbindelser kan ikke bare avledes fra CO-gass, men også fra karbonsyre, HtoCO3 eller OH- (C = O) -OH. Her representerer de to OH R og R ', og erstatter enten ett av dem eller deres hydrogener, erholdes derivater av karbonsyre.
Og så er det derivatene av karboksylsyrer, RCOOH, oppnådd ved å endre identiteten til R, eller erstatte H med et annet atom eller kjede R '(som vil gi opphav til en ester, RCOOR').
Hvordan identifisere det i aldehyder og ketoner
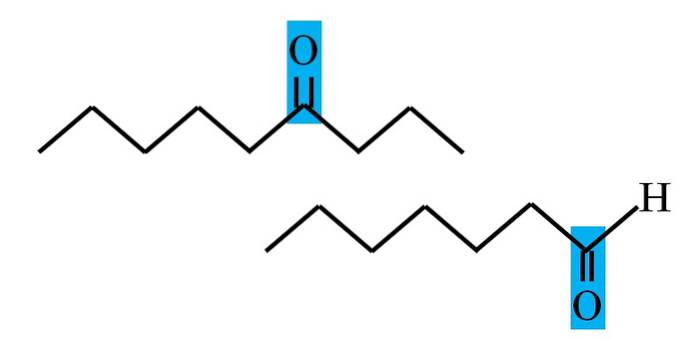
Både aldehyder og ketoner har tilstedeværelsen av karbonylgruppen til felles. Dens kjemiske og fysiske egenskaper skyldes det. Imidlertid er deres molekylære miljø ikke det samme i begge forbindelser; i førstnevnte er den i en terminal posisjon, og i sistnevnte, hvor som helst i kjeden.
For eksempel, i bildet over er karbonylgruppen inne i en blå boks. I ketoner, ved siden av denne boksen, må det være et annet karbon- eller kjedesegment (øverst); mens i aldehyder kan det bare være ett hydrogenatom (nederst).
Hvis C = O er i den ene enden av kjeden, vil det være et aldehyd; det er den mest direkte måten å skille den fra en keton.
ID
Men hvordan vet du eksperimentelt om en ukjent forbindelse er et aldehyd eller et keton? Det er mange metoder, fra spektroskopiske (absorpsjon av infrarød stråling, IR) eller kvalitative organiske tester.
Når det gjelder kvalitative tester, er disse basert på reaksjoner som, når positive, analytikeren vil observere en fysisk respons; en endring i farge, frigjøring av varme, dannelse av bobler osv..
For eksempel når du tilsetter en syreoppløsning av KtoCrtoELLER7 aldehydet vil skifte til karboksylsyre, noe som får løsningen til å endre seg fra oransje til grønn (positiv test). I mellomtiden reagerer ikke ketonene, og derfor observerer ikke analytikeren noen fargeendring (negativ test).
En annen test består av bruk av Tollens-reagens, [Ag (NH3)to]+, for at aldehydet reduserer Ag-kationer+ til metallisk sølv. Og resultatet: dannelsen av et sølvspeil nederst på reagensrøret der prøven ble plassert..
Hovedeksempler
Til slutt vil en rekke eksempler på karbonylforbindelser bli oppført:
-CH3COOH, eddiksyre
-HCOOH, maursyre
-CH3Bil3, propanon
-CH3BiltoCH3, 2-butanon
-C6H5Bil3, acetofenon
-CH3CHO, ethanal
-CH3CHtoCHtoCHtoCHO, pentanal
-C6H5CHO, benzaldehyd
-CH3CONHto, acetamid
-CH3CHtoCHtoCOOCH3, propylacetat
Nå, hvis eksempler på forbindelser som bare har denne gruppen er sitert, vil listen bli nesten uendelig.
Referanser
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. Amines. (10. utgave.). Wiley pluss.
- Reid Danielle. (2019). Carbonyl Group: Egenskaper og oversikt. Studere. Gjenopprettet fra: study.com
- Sharleen Agvateesiri. (5. juni 2019). Carbonyl-gruppen. Kjemi LibreTexts. Gjenopprettet fra: chem.libretexts.org
- Wiki Kids Ltd. (2018). Karbonylforbindelser. Gjenopprettet fra: ganske enkelt. Vitenskap
- Toppr. (s.f.). Nomenklatur og struktur for Carbonyl Group. Gjenopprettet fra: toppr.com
- Clark J. (2015). Oksidasjon av aldehyder og ketoner. Gjenopprettet fra: chemguide.co.uk



Ingen har kommentert denne artikkelen ennå.