
Heptan (C7H16) struktur, egenskaper og bruksområder
De heptan er en organisk forbindelse hvis kjemiske formel er C7H16 og består av ni strukturelle isomerer, hvorav den mest kjente er lineær. Det er et hydrokarbon, spesielt et alkan eller parafin, som finnes i de fleste organiske kjemilaboratorier, enten det er undervisning eller forskning..
I motsetning til andre parafiniske løsningsmidler, har heptan lavere flyktighet, noe som gjør det relativt tryggere å bruke; forutsatt at det ikke er noen varmekilde som omgir dampene dine, og at du jobber inne i en avtrekkshette. Med unntak av brennbarheten, er det en forbindelse inert nok til å tjene som et medium for organiske reaksjoner..
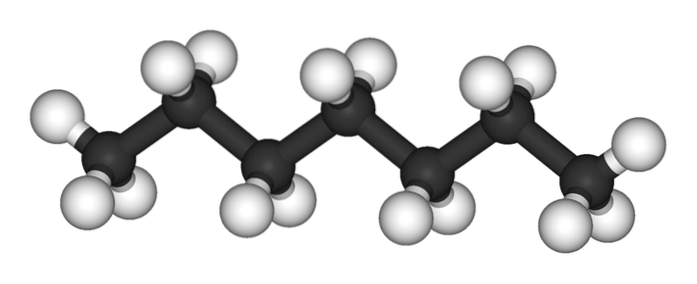
Det øvre bildet viser strukturen til n-heptan, den lineære isomeren av alle heptaner. Fordi det er den vanligste og kommersielt verdifulle isomeren, så vel som den enkleste å syntetisere, har det en tendens til å forstås at begrepet 'heptan' refererer utelukkende til n-heptan; med mindre annet er angitt.
Imidlertid spesifiserer flaskene med denne flytende forbindelsen at den inneholder n-heptan. De må avdekkes inne i en avtrekksvifte, og målingene må tas nøye.
Det er et utmerket løsningsmiddel for fett og oljer, og det er derfor det ofte brukes under ekstraksjoner av planteessenser eller andre naturlige produkter..
Artikkelindeks
- 1 Struktur
- 1.1 n-heptan og dets intermolekylære interaksjoner
- 1.2 Isomerer
- 2 Egenskaper av heptan
- 2.1 Fysisk utseende
- 2.2 Molarmasse
- 2.3 Smeltepunkt
- 2.4 Kokepunkt
- 2.5 Damptrykk
- 2.6 Tetthet
- 2.7 Løselighet i vann
- 2.8 Løselighet i andre løsningsmidler
- 2.9 Brytningsindeks (nD)
- 2.10 Viskositet
- 2.11 Varmekapasitet
- 2.12 Flammepunkt
- 2.13 Selvantennelsestemperatur
- 2.14 Overflatespenning
- 2.15 Forbrenningsvarme
- 2.16 Reaktivitet
- 3 bruksområder
- 3.1 Løsemiddel og reaksjonsmedium
- 3.2 Nedbørsmiddel
- 3.3 Oktan
- 4 Referanser
Struktur
n-heptan og dets intermolekylære interaksjoner
Som det kan sees på det første bildet, er molekylet av n-Heptan er lineær, og på grunn av den kjemiske hybridiseringen av karbonatomer, antar kjeden en sikksakkform. Dette molekylet er dynamisk, ettersom dets CC-bindinger kan rotere og forårsake at kjeden bøyes litt i forskjellige vinkler. Dette bidrar til deres intermolekylære interaksjoner..
De n-heptan er et apolært, hydrofobt molekyl, og derfor er dets interaksjoner basert på Londons spredningskrefter; Dette er de som avhenger av molekylvekten til forbindelsen og dens kontaktareal. To molekyler av n-heptan nærmer seg hverandre på en slik måte at de "kiler" kjedene sine oppå hverandre.
Disse interaksjonene er effektive nok til å holde molekylene i n-Heptan er sammenhengende i en væske som koker ved 98 ºC.
Isomerer
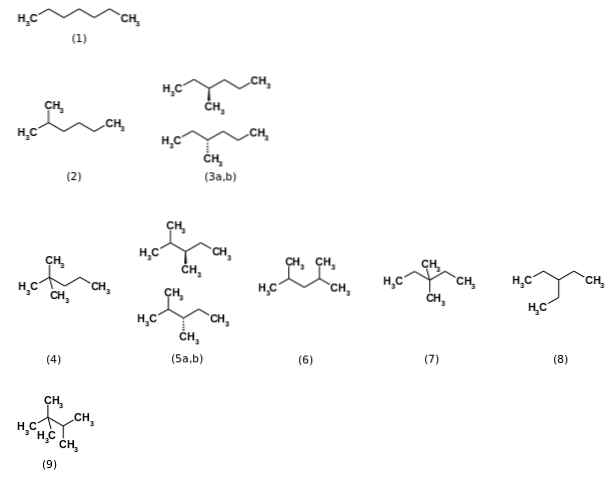
Først ble det sagt at formelen C7H16 representerte totalt ni strukturelle isomerer n-heptan den mest relevante (1). De øvrige åtte isomerer er vist på bildet ovenfor. Legg merke til et øyeblikk at noen er mer forgrenet enn andre. Fra venstre til høyre, med start fra toppen, har vi:
(2): 2-metylheksan
(3): 3-metylheksan, som består av et par enantiomerer (a og b)
(4): 2,2-dimetylpentan, også kjent som neoheptan
(5): 2,3-dimetylpentan, igjen med et par enantiomerer
(6): 2,4-dimetylpentan
(7): 3,3-dimetylpentan
(8): 3-etylpentan
(9): 2,2,3-trimetylbutan.
Hver av disse isomerer har egenskaper og applikasjoner uavhengig av n-heptan, reservert mest for organiske synteseområder.
Heptan egenskaper
Fysisk utseende
Fargeløs væske med en bensinlignende lukt.
Molarmasse
100,205 g / mol
Smeltepunkt
-90,549 ºC, blir en molekylær krystall.
Kokepunkt
98,38 ºC.
Damptrykk
52,60 atm ved 20 ° C. Legg merke til hvor høyt damptrykket er, til tross for at det er mindre flyktig enn andre parafiniske løsningsmidler, slik som heksan og pentan..
Tetthet
0,6795 g / cm3. På den annen side er heptandamp 3,45 ganger tettere enn luft, noe som betyr at dampene vil henge i rom der litt væske søl..
Vannløselighet
Heptan, som er en hydrofob forbindelse, kan knapt oppløses i vann for å produsere en løsning med en konsentrasjon på 0,0003% ved en temperatur på 20 ºC..
Løselighet i andre løsningsmidler
Heptan kan blandes med karbontetraklorid, etanol, aceton, lett petroleum og kloroform..
Brytningsindeks (nD)
1.3855.
Viskositet
0,389 mPa s
Varmekapasitet
224,64 J / K mol
antennelsespunkt
-4 ºC
Selvantennelsestemperatur
223 ºC
Overflatespenning
19,66 mN / m ved 25 ºC
Forbrenningsvarme
4817 kJ / mol.
Reaktivitet
Heptandamp i nærheten av en varmekilde (en flamme) reagerer eksotermt og kraftig med oksygenet i luften:
C7H16 + 11Oto => 7COto + 8HtoELLER
Utenfor forbrenningsreaksjonen er heptan imidlertid en ganske stabil væske. Dens manglende reaktivitet skyldes at det er vanskelig å bryte C-H-bindingene, så det er ikke utsatt for substitusjoner. På samme måte er det ikke veldig følsomt for sterke oksidasjonsmidler, så lenge det ikke er brann i nærheten..
Den største faren for heptan er dens høye flyktighet og brennbarhet, så det er fare for brann hvis det søles på varme steder.
applikasjoner
Løsemiddel og reaksjonsmedium

Den hydrofobe karakteren til heptan gjør det til et utmerket løsningsmiddel for oppløsning av oljer og fett. I dette aspektet har det blitt brukt som avfettingsmiddel. Imidlertid ligger den største anvendelsen i å bli brukt som et ekstraherende løsningsmiddel, siden det løser opp lipidkomponentene, så vel som de andre organiske forbindelsene i en prøve..
Hvis du for eksempel ønsket å trekke ut alle komponentene i malt kaffe, ville den bli maserert i heptan i stedet for vann. Denne metoden og dens variasjoner er implementert med alle typer frø, takket være at planteessenser og andre naturlige produkter er oppnådd..
Heptan, som er naturlig fargeløst, vil tones til fargen på den ekstraherte oljen. Deretter roteres den for å endelig ha et volum av oljen som er så ren som mulig..
På den annen side tillater den lave reaktiviteten til heptan det også å være et alternativ når man vurderer et reaksjonsmedium for å utføre en syntese. Å være et godt løsningsmiddel for organiske forbindelser, sikrer det at reagensene forblir i oppløsning og samhandler riktig med hverandre mens de reagerer.
Nedbørsmiddel
I petroleumskjemi er det vanlig å utfelle asfaltener fra en rå prøve ved å tilsette heptan. Denne metoden gjør det mulig å studere stabiliteten til forskjellige råoljer og bestemme hvor mottakelig deres asfalteninnhold er for utfelling og forårsaker en hel rekke problemer for oljeindustrien..
Octane
Heptan har blitt brukt som drivstoff på grunn av den store mengden varme den gir fra seg når den brenner. Men når det gjelder bilmotorer, vil det være skadelig for ytelsen hvis de brukes i ren form. Fordi den brenner veldig eksplosivt, tjener den til å definere 0 på bensinoktanskalaen..
Bensin inneholder en høy prosentandel heptan og andre hydrokarboner for å bringe oktantallet opp til kjente verdier (91, 95, 87, 89, etc.).
Referanser
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kjemi. 5. utgave. Redaksjonell Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kjemi. (10. utgave.). Wiley pluss.
- Wikipedia. (2020). Heptan. Gjenopprettet fra: en.wikipedia.org
- Nasjonalt senter for bioteknologisk informasjon. (2020). Heptane PubChem-database. CID = 8900. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Heptaner ScienceDirect. Gjenopprettet fra: sciencedirect.com
- Bell Chem Corp. (7. september 2018). Industriell bruk av heptan. Gjenopprettet fra: bellchem.com
- Andrea Kropp. (2020). Heptan: Struktur, bruk og formel. Studere. Gjenopprettet fra: study.com



Ingen har kommentert denne artikkelen ennå.