
Natriumhydroksid (NaOH) struktur, egenskaper, bruksområder, syntese

De natriumhydroksid Det er en uorganisk forbindelse med kjemisk formel som NaOH og består av en veldig sterk metallisk base eller alkali. En 5% løsning av den i vann har en pH nær 14.
Det er et veldig hygroskopisk hvitt fast stoff som også kan absorbere karbondioksid fra luften for å danne natriumkarbonat. Den kommer kommersielt i plastflasker som piller, som ikke kan eksponeres for lenge for luften, og de skal heller ikke manipuleres med spatler.

Natriumhydroksyd kan syntetiseres ved å reagere kalsiumhydroksid med natriumkarbonat. Foreløpig er det imidlertid syntetisert ved elektrolyse av saltlake, og er et biprodukt fra produksjonen av klorgass.
Gitt den høye basaliteten til NaOH, har den mange bruksområder og anvendelser, som produksjon av papir, såper, vaskemidler, fargestoffer osv. Det brukes også i husholdningsrengjøring, vannbehandling, aluminiumsbehandling, medisinproduksjon osv. og fremfor alt er det et sekundært mønster par excellence.
Natriumhydroksid er veldig etsende og kan forårsake irritasjon og forbrenning i hud og øyne. Ved å inhalere støvet kan det forårsake lungeødem. I mellomtiden kan inntaket forårsake så alvorlig skade på fordøyelseskanalen at det kan føre til døden..
Artikkelindeks
- 1 Struktur
- 1.1 Vannfri
- 1.2 Hydrater
- 2 Fysiske og kjemiske egenskaper
- 2.1 Navn
- 2.2 Molarmasse
- 2.3 Utseende
- 2.4 Smeltepunkt
- 2.5 Kokepunkt
- 2.6 Løselighet i vann
- 2.7 Grunnleggende (pKb)
- 2,8 pH
- 2.9 Brytningsindeks (nD)
- 2.10 Stabilitet
- 2.11 Nedbrytning
- 2.12 Selvantennelsespunkt
- 2.13 Viskositet
- 2.14 Fordampningsvarme
- 2.15 Overflatespenning
- 2.16 Reaktivitet
- 3 Syntese
- 3.1 Reaksjon av natriumkarbonat og kalsiumhydroksid
- 3.2 Elektrolyse av natriumklorid
- 4 bruksområder
- 4.1 Rengjøringsprodukter
- 4.2 Legemidler og legemidler
- 4.3 Energiprosesser
- 4.4 Vannbehandling
- 4.5 Papirfremstilling
- 4.6 Industriell produksjon
- 5 risikoer
- 6 Referanser
Struktur
Vannfri

Det øvre bildet viser ionene som utgjør NaOH. Na-kasjonen+ er representert av den lilla sfæren, mens hydroksylanionet (hydroksyd eller hydroksyl) OH- ved den røde og hvite sfæren. Begge Na-ionene+ og OH- samhandle med hverandre gjennom den elektrostatiske tiltrekningen av deres motsatte ladninger.
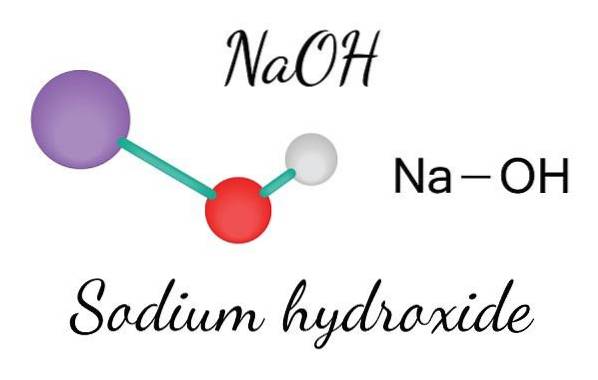
Slike interaksjoner er ikke-retningsbestemte, så attraksjonene til et ionepar Na+Åh- det kan påvirke andres på en viss avstand. Resultatet er at Na-ionene+ frastøte hverandre, på samme måte som OH-, inntil de definerer en krystall av minimumsenergi der de etablerer en ordnet og periodisk struktur (krystallinsk).
Derfor vises de ortorombiske krystallene av vannfri NaOH (uten vann):
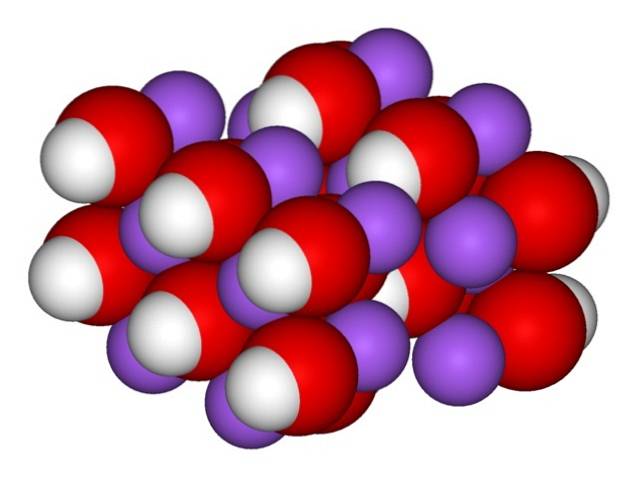
Ionene forblir tilstrekkelig sammenhengende slik at det vannfrie NaOH-krystallet smelter ved 323 ºC (så lenge det ikke er fuktighet i miljøet).
Hydrater
Både Na+ som OH- De er ioner som vannmolekyler lett solverer (hydrerer). Dette favoriserer hydrering over krystallens retikulære energi, og derfor frigjør NaOH mye energi når den kommer i kontakt med vann..
Imidlertid kan vannfrie krystaller være vert for uløste vannmolekyler; det vil si at natriumhydroksyd kan danne mange hydrater, NaOH nHtoO. Vannmolekylet kan godt danne en hydrogenbinding med OH- (HOH-OH-), eller koordinere med Na+ (Na+-Åhto).
Avhengig av molforholdet mellom NaOH og H.toEller monohydrater (NaOHHtoO), dihydrater (NaOH 2HtoO), trihemidrater (NaOH 3,5HtoO), tetrahydrater (NaOH 4HtoO), heptahydrater (NaOH 7HtoO), og mer.
Hver av disse hydratene kan krystallisere fra en vandig løsning av NaOH med forskjellige masseprosenter og ved forskjellige temperaturer. Følgelig viser NaOH et komplisert vannløselighetsdiagram..
Generelt er krystallene av hydrater mindre tette og har lavere smeltepunkter. Dette er fordi vannmolekylene "hindrer" interaksjonen mellom Na+ og OH-, legge til dipol-dipolkrefter ved ofring av ioniske attraksjoner.
Fysiske og kjemiske egenskaper
Navn
IUPAC foretrukket navn: natriumhydroksid. Andre navn: Kaustisk brus, Askaritt (mindre vanlig)
Molarmasse
39,9971 g / mol
Utseende
Hvitt, serøst eller ugjennomsiktig fast stoff eller krystaller.
Smeltepunkt
323 ºC
Kokepunkt
1.388 ºC
Vannløselighet
1000 g / l ved en temperatur på 25 ° C. Dette viser hvor mye det kan oppløses i vann..
De vandige løsningene er viskøse, med en viskositetsverdi omtrent åtti ganger så mye som vann, og de frigjør mye varme i begynnelsen. Hvis du har kontakt med dem, gjør de huden glatt på grunn av forsåpningen av fettsyrene i huden..
Grunnleggende (pKb)
- 0,56
pH
En 5% vekt / vekt løsning i vann har en pH nær 14
Brytningsindeks (nD)
Ved en bølgelengde på 580,4 nm: 1433 ved 320 ° C, og 1421 ved 420 ° C.
Stabilitet
Beholdere som inneholder den, må lukkes hermetisk for å forhindre dannelse av natriumkarbonat. Dette skyldes den høye hygroskopisiteten, som fører til at den absorberer fuktighet fra omgivelsene og CO-innholdet.to.
Nedbrytning
Ved oppvarming til nedbrytning avgir den natriumoksydrøyk.
Selvantennelsespunkt
Det er ikke brannfarlig
Viskositet
4,0 cPoise ved 350 ºC
Fordampningsvarme
175 kJ / mol ved 1388 ºC
Overflatespenning
74,35 dynes / cm i en 2,72% vekt / vekt løsning i vann ved 18 ºC.
Reaktivitet
Med syrer
Reagerer med organiske og uorganiske mineralsyrer, og skaper vann og det tilsvarende saltet. Når det gjelder svovelsyre, er reaksjonen eksoterm.
2 NaOH + HtoSW4 => NatoSW4 + 2 timertoELLER
Med syreoksider
Reagerer med svoveldioksid, for eksempel, og gir et sulfitt salt av og vann:
2 NaOH + SOto => NatoSW3 + HtoELLER
Med metaller
De vandige løsningene reagerer med noen metaller for å produsere komplekse natriumsalter. For eksempel gir reaksjonen med sink et natriumsinkat:
Zn + 2 NaOH + 2 HtoO => Nato[Zn (OH)4] + Hto
Syntese
Natriumhydroksyd syntetiseres hovedsakelig ved to metoder: bruk av natriumkarbonat, opprinnelig brukt, og elektrolyse av natriumklorid, for tiden i større industriell bruk..
Reaksjon av natriumkarbonat og kalsiumhydroksid
Natriumkarbonat reagerer med kalsiumhydroksid i en prosess kjent som kaustisering:
Ca (OH)to + NatoCO3 => CaCO3 + NaOH
Kalsiumkarbonat utfelles, og etterlater natriumhydroksid i supernatanten, som konsentreres ved fordampning.
Natriumkarbonat kommer tidligere fra Solvay-prosessen:
2 NaCl + CaCO3 => NatoCO3 + CaClto
Elektrolyse av natriumklorid
Elektrolysen av natriumklorid, som er tilstede i saltlake, produserer hydrogengass, kloridgass og natriumhydroksid i vandig løsning:
2 Nacl + 2 HtoO => Hto + Clto + 2 NaOH
Det elektrolytiske kammeret består av et rom der anoden (+) er, laget av titanmetall, og et sted der saltlake er plassert. Dette rommet er skilt fra katodekammeret (-) med en porøs membran..
Følgende reaksjon skjer ved anoden:
2 Cl- => Clto + 2 e- (oksidasjon)
I mellomtiden skjer denne reaksjonen ved katoden:
2 timertoO + 2 e- => Hto + Åh- (reduksjon)
Natrium (Na+) diffunderer fra anodekammeret til katodekammeret, gjennom membranen som skiller dem, og danner natriumhydroksid.
applikasjoner
Rengjøringsprodukter
Natriumhydroksid brukes til å lage såper og vaskemidler som brukes i hjemmet og i virksomheten. Kombinasjonen av natriumhydroksid og klor gir klorblekemiddel som brukes til å vaske hvite klær.
Det eliminerer også opphopning av fett i avløpene, og produserer dets eliminering gjennom omdannelse til såper gjennom forsåpningsprosessen. Dette muliggjør eliminering av blokkering av rørene til hjemmene og andre bygninger.
Farmasøytiske og medisinske produkter
Natriumhydroksid brukes til å lage vanlige smertestillende midler, som aspirin. Også av legemidler med antikoagulerende virkning som blokkerer dannelsen av blodpropp og medikamenter for å redusere hyperkolesterolemi.
Energiprosesser
Natriumhydroksid brukes til fremstilling av brenselceller som fungerer som batterier for å produsere elektrisitet for en rekke bruksområder, inkludert transport. Epoksyharpikser, produsert med intervensjon av natriumhydroksid, brukes i vindturbiner.
Vannbehandling
Natriumhydroksyd brukes til å nøytralisere surheten i vannet og bidra til fjerning av tungmetaller fra det. Det brukes også til produksjon av natriumhypokloritt, et vanndesinfeksjonsmiddel.
Natriumhydroksyd reageres med aluminiumsulfat for å danne aluminiumhydroksid: et flokkuleringsmiddel som brukes i vannbehandlingsanlegg for å øke sedimenteringen av partikler, noe som gir klarhet..
Papirlaging
Natriumhydroksid brukes sammen med natriumsulfid i behandlingen av tre for å oppnå cellulose, i en nesten ren form, som danner grunnlaget for papir. Det brukes også til resirkulering av papir, siden det hjelper å skille blekk, slik at det kan brukes igjen.
Industriell produksjon
Natriumhydroksid brukes til fremstilling av rayon, spandex, eksplosiver, epoksyharpikser, glass og keramikk. Den brukes i tekstilindustrien til å lage fargestoffer og prosessere bomullsstoffer.
I sukkerrørrenseanlegg brukes natriumhydroksid med lav temperatur til produksjon av etanol fra sukkerrør bagasse.
Risiko
Natriumhydroksid er en meget etsende forbindelse, så det kan forårsake, ved hudkontakt, forbrenning, blemmer og til og med permanente arr.
I kontakt med øynene kan det forårsake alvorlige forbrenninger, hevelse, smerte, tåkesyn, og i alvorlige tilfeller kan det forårsake permanent blindhet..
Svelging av natriumhydroksid kan forårsake forbrenning i lepper, tunge, hals, spiserør og mage. Vanlige symptomer inkluderer kvalme, oppkast, magekramper og diaré..
Selv om innånding av natriumhydroksid er sjelden, og bare kan forekomme på grunn av tilstedeværelsen av støv av forbindelsen i luften eller fra dannelsen av en tåke som inneholder den, gir det irritasjon i lungene..
Ved kronisk eksponering kan dette forårsake lungeødem og alvorlig kortpustethet, noe som utgjør en medisinsk nødsituasjon..
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2019). Natriumhydroksid. Gjenopprettet fra: en.wikipedia.org
- Nasjonalt senter for bioteknologisk informasjon. (2019). Natriumhydroksid. PubChem-database. CID = 14798. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- Amerikanske elementer. (2019). Natriumhydroksydløsning. Gjenopprettet fra: americanelements.com
- Kjemiske sikkerhetsfakta. (2019). Natriumhydroksid. Gjenopprettet fra: chemicalafetyfacts.org
- NJ Helse. (2015). Natriumhydroksid. [PDF]. Gjenopprettet fra: nj.gov
- Canadian Center for Occupational Health & Safety. (2019). OSH Answers Faktaark: natriumhydroksid. Gjenopprettet fra: ccohs.ca
- Ausetute. (s.f.). Natriumhydroksid og klorproduksjon ved elektrolyse. Gjenopprettet fra: ausetute.com.au



Ingen har kommentert denne artikkelen ennå.