
Immunfluorescens begrunnelse, protokoll og applikasjoner
De immunfluorescens er en kraftig immunfargingsteknikk som bruker antistoffer kovalent koblet til fluorescerende molekyler for å identifisere spesifikke mål i celleprøver festet på en solid støtte.
Denne teknikken innebærer mikroskopisk observasjon med immunologisk spesifisitet, noe som gjør det mulig å observere levende eller døde celler som kan presentere små mengder antigener. Det brukes mye både innen forskningsfeltet og i klinisk diagnose av forskjellige patologier.
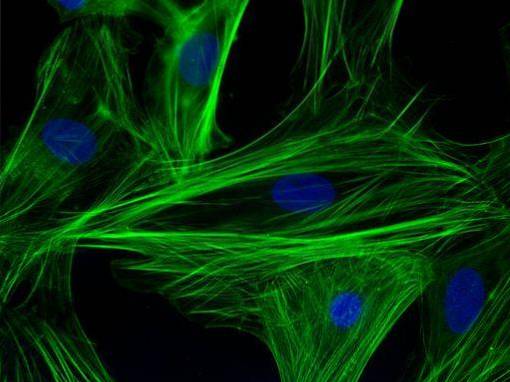
Denne teknikken, hovedsakelig kvalitativ (med noen kvantitative varianter), har å gjøre spesifikt med visualisering av en prøve ved produktsignalet fra en fluorofor, som er et fluorescerende molekyl bundet til et antistoff og som er i stand til å bli eksitert ved en viss bølgelengde. ..
I cellesammenheng er det veldig nyttig å studere tilstedeværelse / fravær og subcellulær plassering av proteiner. Teknikken ble brukt i sine tidlige dager i klinisk setting for diagnostisering av virus som influensa og deretter for mange andre smittsomme sykdommer..
Det er en veldig sensitiv teknikk, og med riktig mikroskopiutstyr kan den ha veldig god oppløsning. Det krever, for observasjon, bruk av konfokale eller epifluorescensmikroskop.
Til tross for at det er veldig populært, kan det imidlertid by på noen viktige problemer med hensyn til å oppnå uspesifikk fluorescens som genererer noe bakgrunnsstøy, som ofte begrenser tilstrekkelig lesing av resultatene..
Artikkelindeks
- 1 Begrunnelse
- 2 Protokoll
- 2.1 -Forberedelse
- 2.2 Fiksering av prøver
- 2.3 Permeabilisering
- 2.4 Blokkering
- 2.5 Immunfarging eller immunfarging
- 2.6 Montering og observasjon
- 3 typer
- 3.1 Direkte eller primær immunfluorescens
- 3.2 Indirekte eller sekundær immunfluorescens
- 4 Søknader
- 5 Referanser
Basis
Immunfluorescens er basert på utnyttelse av det biologiske fenomenet av interaksjonsreaksjonen mellom et antistoff og et antigen. Det har å gjøre spesifikt med visualisering eller påvisning av denne reaksjonen av spennende fluorescerende molekyler ved en bestemt bølgelengde.
Et antistoff er et immunoglobulinprotein utskilt fra aktive B-celler, som genereres spesifikt mot et antigen, som det kan binde seg til med stor affinitet og spesifisitet. Immunfluorescens bruker IgG-immunglobuliner, som er løselig i blodserum..
Antistoffer er molekyler opptil 950 kDa sammensatt av to korte (lette) og to lange "Y" -formede (tunge) peptidkjeder. Både lette og tunge kjeder er delt inn i to domener: en variabel, som er i stand til å gjenkjenne antigenet, og en annen konstant eller konservert, karakteristisk for hver art..
Antigener er funksjonelt definert som molekyler som kan gjenkjennes av et antistoff og som for det meste er proteiner. Når et dyr utsettes for et antigen, aktiveres lymfocyttene i immunsystemet, og produserer spesifikke antistoffer mot det og fungerer som et forsvarssystem..
Et antigen, slik som et protein, kan for eksempel ha mer enn en epitop eller et sted for gjenkjenning av et antistoff, så serumet til dyret som er eksponert for et antigen kan ha polyklonale antistoffer mot forskjellige regioner av det samme proteinet..
Immunfluorescens utnytter deretter et dyrs evne til å produsere polyklonale antistoffer mot et spesifikt antigen for å rense det og deretter bruke det til påvisning av det samme antigenet i andre sammenhenger..
Blant de fluorescerende fargestoffene eller molekylene som er mest brukt for noen immunfluorescensteknikker, er fluoresceinisotiocyanat (FITC), tetrametylrhodaminisotiocyanat-5 og 6 (TRITC), mange cyaniner som Cy2, Cy3, Cy5 og Cy7 og fargestoffer kalt Alexa Fluor®, som Alexa Fluor®448.
Protokoll
Immunofluorescensprotokollen varierer avhengig av mange faktorer, men generelt omfatter den en lineær sekvens av trinn som består av:
- Klargjøring av lysbilder og celler
- Fiksering av prøver
- Permeabilisering
- Blokkering
- Immunfarging eller immunfarging
- Montering og observasjon
-Forberedelse
Av prøvene
Utarbeidelsen av prøvene vil avhenge av arten og typen erfaring som skal utføres. Deretter vil det enkleste tilfellet bli forklart, som innebærer bruk av celler i suspensjon..
Celler i suspensjon, det vil si i et flytende dyrkningsmedium, må først skilles fra det ved sentrifugering og deretter vaskes med en bufferløsning eller "buffer" isosmotisk, og bevarer sin integritet.
Normalt brukes en fosfat-saltbuffer kjent som PBS, hvor cellene resuspenderes og denne blandingen sentrifugeres igjen for å oppnå cellene fri for dyrkningsmediet, som kan inneholde forstyrrende stoffer..
Av bladene
Lysbildene som brukes til mikroskopisk observasjon, der cellene senere blir fikset for tilsvarende nedstrømsbehandlinger, må også være nøye forberedt..
Disse er dekket eller "sensibilisert" med en løsning av poly-lysin, en syntetisk polymer som vil fungere som et "molekylært lim" mellom cellene og den faste bæreren, takket være den elektrostatiske interaksjonen mellom de positive ladningene til deres aminogrupper og celler. negative ladninger på proteinene som belegger celler.
Fiksering av prøver
Denne prosessen består i å immobilisere proteinene som finnes i cellen for å holde deres romlige beliggenhet intakt. Molekylene som brukes må være i stand til å krysse alle typer cellemembraner og danne gitter med kovalente proteiner..
Formaldehyd og paraformaldehyd, glutaraldehyd og til og med metanol brukes mye, med hvilke celleprøver inkuberes i en viss periode og deretter vaskes med en isosmotisk bufferløsning.
Etter å ha fiksert cellene, blir de fortsatt festet til arkene som tidligere ble sensibilisert med poly-lysin..
Permeabilisering
Avhengig av type test som blir utført, vil det være nødvendig å permeabilisere cellene som studeres eller ikke. Hvis det som søkes er å vite plasseringen, tilstedeværelsen eller fraværet av et bestemt protein på celleoverflaten, vil permeabilisering ikke være nødvendig.
På den annen side, hvis du vil vite plasseringen av et protein inne i cellen, er permeabilisering viktig og vil bestå av å inkubere prøvene med Triton X-100, et vaskemiddel som er i stand til å permeabilisere cellemembraner..
Blokkering
Et grunnleggende trinn i alle immunologiske teknikker er blokkering. På dette stadiet av prosedyren består blokkering av å dekke, i de sensibiliserte arkene, alle stedene med poly-lysinmolekyler som celler ikke fester seg til. Det vil si at det forhindrer enhver uspesifikk union.
Normalt brukes blokkerende løsninger med bovint serumalbumin (BSA) i PBS-buffer, og de beste resultatene oppnås jo lenger inkubasjonstiden med denne løsningen. Etter hvert trinn, inkludert blokkering, er det nødvendig å vaske av den gjenværende løsningen..
Immunfarging eller immunfarging
Immunfarging eller immunfarging vil hovedsakelig avhenge av om det er en direkte eller indirekte immunfluorescens (se nedenfor)..
Hvis det er en primær eller direkte immunfluorescens, vil prøvene bli inkubert med de ønskede antistoffene, som må kobles til de fluorescerende fargestoffene. Inkubasjonsprosedyren består i å lage en fortynning av antistoffet i en løsning som også inneholder BSA, men i en lavere andel.
Når saken er sekundær eller indirekte immunfluorescens, bør det utføres to påfølgende inkubasjoner. Først med de ønskede antistoffene og deretter med antistoffene som er i stand til å oppdage de konstante områdene til de primære immunglobuliner. Det er disse sekundære antistoffene som er kovalent bundet til fluoroforer..
Teknikken er veldig allsidig, og tillater samtidig merking av mer enn ett antigen per prøve, så lenge det er primære antistoffer koblet til forskjellige fluoroforer, i tilfelle direkte immunfluorescens..
For samtidig merking i indirekte immunfluorescens er det nødvendig å sikre at hvert primære antistoff blir produsert i et annet dyr, samt at hvert sekundære antistoff er koblet til en annen fluorofor..
Som blokkering, gir inkubasjon med antistoffer bedre resultater jo lenger inkubasjonstiden er. Etter hvert trinn er det nødvendig å vaske overflødig antistoffer som ikke binder seg til prøvene, og i den sekundære immunfluorescensen er det nødvendig å blokkere før det sekundære antistoffet tilsettes..
Enkelte teknikker bruker andre flekker som ikke er relatert til immunfarging, for eksempel farging av nukleært DNA med DAPI-fluoroforen..
Montering og observasjon
I løpet av den siste inkubasjonstiden med fluoroforene er det nødvendig at prøvene forblir i mørket. For mikroskopisk observasjon er det vanlig å bruke noen stoffer for å bevare fluorescensen til fluoroforene koblet til antistoffene..
Typer
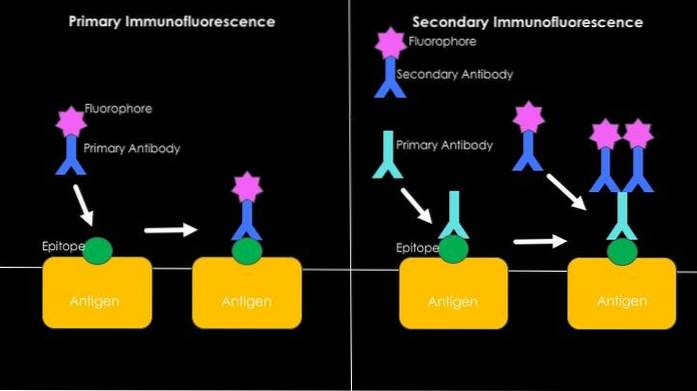
Direkte eller primær immunfluorescens
Det har å gjøre med påvisning av antigener ved bruk av fluorescerende antistoffer. Den største fordelen med å bruke denne teknikken er dens hastighet, men mange tilfeller av uspesifikk binding kan forekomme i prosessen, spesielt når man studerer humant sera, da de er rike på svært heterogene antistoffer..
Indirekte eller sekundær immunfluorescens
Det er også kjent som "sandwich" -teknikken, og dette innebærer utvikling av teknikken i to trinn. Den første har å gjøre med bruken av et ikke-fluorescerende antistoff og dets binding til antigenet av interesse..
Mot den konstante regionen av dette første antistoffet (som nå vil tjene som antigen) brukes et andre antistoff som er i stand til å gjenkjenne det, som er assosiert med et fluorescerende molekyl.
Utseendet til et fluorescerende signal vil være resultatet av spesifikk gjenkjenning mellom det første ikke-fluorescerende antistoffet og antigenet av interesse; tilstedeværelsen av dette første antistoffet bestemmer det for det andre, som er merket, og takket være hvilket tilstedeværelsen eller fraværet av antigenet kan bestemmes.
Til tross for å være en mye mer tidkrevende teknikk enn direkte immunfluorescens (da den inkluderer ett inkubasjonstrinn til), involverer denne teknikken ikke utformingen av et fluorescerende antistoff for hvert antigen som studeres, noe som i økonomisk henseende resulterer i mer levedyktig.
Videre er det en mer sensitiv teknikk når det gjelder signalforsterkning, siden mer enn ett sekundært antistoff kan binde seg til det konstante området til det primære antistoffet, og dermed forsterke intensiteten til det fluorescerende signalet..
applikasjoner
Som kan ha blitt bemerket tidligere, er immunfluorescens en ekstremt allsidig teknikk som har fått en rekke bruksområder innen det vitenskapelige og kliniske området. Den kan brukes til å svare på økologiske, genetiske og fysiologiske spørsmål angående mange organismer.
Blant de kliniske anvendelsene brukes den til direkte diagnose av noen dermatologiske sykdommer, enten ved bruk av direkte eller indirekte immunfluorescens på epitelvevet hos de studerte pasientene..
Immunfluorescensteknikker har vært tilgjengelige i encellede organismer som gjær for å visualisere intranukleære og cytoplasmatiske mikrotubuli, aktin og tilknyttede proteiner, 10 nm filamenter og andre bestanddeler av cytoplasma, membran og cellevegger..
Referanser
- Abcam, immuncytokjemi og immunfluorescensprotokoll. Hentet fra abcam.com
- Greph, C. (2012). Fluorescerende fargestoffer. Hentet fra leica-microsystems.com
- Miller, D. M., og Shakest, D. C. (1995). Immunfluorescensmikroskopi. I Metoder i cellebiologi (Vol. 48, s. 365-394). Academic Press, Inc..
- Odell, I. D., & Cook, D. (2013). Immunfluorescensteknikker. Journal of Investigative Dermatology, 133, 1-4.
- Princle, B. J. R., Adams, A. E. M., Druain, D. G., & Brian, K. (1991). Immunfluorescensmetoder for gjær. I Metoder for enzymologi (Vol. 194, s. 565-602). Academic Press, Inc..
- Schaeffer, M., Orsi, E. V, & Widelock, D. (1964). Anvendelser av immunfluorescens i folkehelsevirologi. Bakteriologiske anmeldelser, 28(4), 402-408.
- Vrieling, E. G. og Anderson, D. M. (1996). Immunfluorescens i planteplanktonforskning: applikasjoner og potensial. J: Phycol., 32, 1-16.



Ingen har kommentert denne artikkelen ennå.