
Lov om masseaksjonsapplikasjoner, eksempler
De lov om massehandling etablerer forholdet mellom de aktive massene til reaktantene og produktene, under likevektsforhold og i homogene systemer (løsninger eller gassfaser). Den ble formulert av norske forskere C.M. Guldberg og P. Waage, som anerkjente at likevekt er dynamisk og ikke statisk.
Hvorfor dynamisk? Fordi hastighetene for fremover og omvendte reaksjoner er like. Aktive masser uttrykkes vanligvis mol / l (molaritet). En slik reaksjon kan skrives slik: aA + bB <=> cC + dD. For likevekten som er nevnt i dette eksemplet, er forholdet mellom reaktanter og produkter illustrert i ligningen i bildet nedenfor.
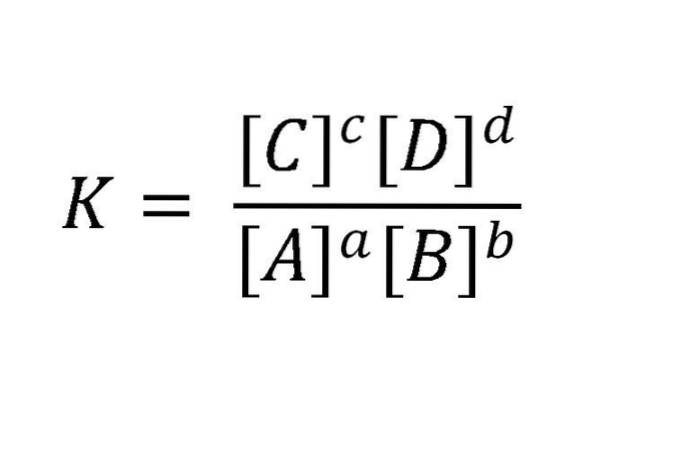
K er alltid konstant, uavhengig av de opprinnelige konsentrasjonene av stoffene, så lenge temperaturen ikke varierer. Her er A, B, C og D reaktantene og produktene; mens a, b, c og d er deres støkiometriske koeffisienter.
Den numeriske verdien av K er en karakteristisk konstant for hver reaksjon ved en gitt temperatur. Deretter er K det som kalles likevektskonstanten.
Notasjonen [] betyr at i det matematiske uttrykket vises konsentrasjonene i enheter mol / L, hevet til en styrke lik reaksjonskoeffisienten.
Artikkelindeks
- 1 Hva er loven om massehandling?
- 1.1 Betydning av likevektskonstanten
- 2 Kjemisk likevekt
- 2.1 Likevekt i heterogene systemer
- 2.2 Likevektsforskyvninger
- 3 Le Chateliers prinsipp
- 4 Søknader
- 5 Eksempler på lov om massehandling
- 6 Loven om massehandling i farmakologi
- 7 Begrensninger
- 8 Referanser
Hva er loven om massehandling?
Som tidligere nevnt, uttrykker loven om massehandling at hastigheten til en gitt reaksjon er direkte proporsjonal med produktet av konsentrasjonene av den reaktante arten, der konsentrasjonen av hver art er forhøyet til en styrke som er dens koeffisient støkiometrisk i kjemikaliet. ligning.
I denne forstand kan det forklares bedre ved å ha en reversibel reaksjon, hvis generelle ligning er illustrert nedenfor:
aA + bB ↔ cC + dD
Der A og B representerer reaktantene og stoffene som heter C og D representerer reaksjonens produkter. Verdiene av a, b, c og d representerer på samme måte de støkiometriske koeffisientene til henholdsvis A, B, C og D..
Med utgangspunkt i den forrige ligningen oppnås likevektskonstanten som er nevnt tidligere, som er illustrert som:
K = [C]c[D]d/[TIL]til[B]b
Der likevektskonstanten K er lik et kvotient, der telleren består av multiplikasjonen av konsentrasjonen av produktene (i likevektstilstand) hevet til deres koeffisient i den balanserte ligningen og nevneren består av en lignende multiplikasjon, men blant reaktantene forhøyet til koeffisienten som følger med dem.
Betydningen av likevektskonstanten
Det skal bemerkes at i ligningen for å beregne likevektskonstanten, må konsentrasjonene av arten i likevekt brukes, så lenge det ikke er noen modifikasjoner av disse eller av temperaturen i systemet..
På samme måte gir verdien av likevektskonstanten informasjon om retningen som er favorisert i en reaksjon ved likevekt, det vil si at den avslører om reaksjonen er gunstig mot reaktantene eller produktene..
Hvis størrelsen på denne konstanten er mye større enn enhet (K "1), vil likevekten skifte til høyre og favorisere produktene; mens hvis størrelsen på denne konstanten er mye mindre enn enhet (K" 1), vil likevekten vippes mot venstre og vil favorisere reaktantene.
Selv om det ifølge konvensjonen er indikert at stoffene på venstre side av pilen er reaktantene og de på høyre side er produktene, blir det faktum at reaktantene som kommer fra reaksjonen i direkte forstand produktene i reaksjonen. omvendt og omvendt.
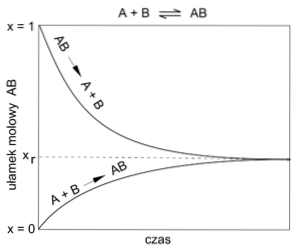
Kjemisk balanse
Reaksjoner når ofte en likevekt mellom mengden av utgangsstoffer og de av produktene som dannes. Denne balansen kan i tillegg forskyves og øker eller reduseres av et av stoffene som deltar i reaksjonen..
Et analogt faktum oppstår i dissosiasjonen av et oppløst stoff: under en reaksjon kan forsvinningen av de første stoffene og dannelsen av produktene observeres eksperimentelt med variabel hastighet.
Reaksjonshastigheten er sterkt avhengig av temperaturen og i varierende grad av konsentrasjonen av reaktantene. Faktisk blir disse faktorene studert spesielt av kjemisk kinetikk.
Denne likevekten er imidlertid ikke statisk, men kommer av sameksistensen av en direkte og en omvendt reaksjon..
I den direkte reaksjonen (->) dannes produktene, mens de er i omvendt reaksjon (<-) estos vuelven a originar las sustancias iniciales.
Ovennevnte utgjør det som er kjent som dynamisk likevekt, nevnt ovenfor..
Likevekt i heterogene systemer
I heterogene systemer - det vil si i de som dannes av flere faser - kan konsentrasjonene av faste stoffer betraktes som konstante, utelatt fra det matematiske uttrykket for K.
Tyv3(s) <=> CaO (s) + COto(g)
I nedbrytningsvekten av kalsiumkarbonat kan dets konsentrasjon og konsentrasjonen av det resulterende oksyd betraktes som konstant uavhengig av dens masse..
Balanseskift
Den numeriske verdien av likevektskonstanten avgjør om en reaksjon favoriserer dannelsen av produkter eller ikke. Når K er større enn 1, vil likevektssystemet ha en høyere konsentrasjon av produkter enn av reaktanter, og hvis K er mindre enn 1, skjer det motsatte: i likevekt vil det være en større konsentrasjon av reaktanter enn produkter..
Le Chatelier-prinsippet
Påvirkningen av variasjoner i konsentrasjon, temperatur og trykk kan endre reaksjonshastigheten.
For eksempel, hvis gassformige produkter dannes i en reaksjon, fører en økning i trykk over systemet til at reaksjonen går i motsatt retning (mot reaktantene).
Generelt er de uorganiske reaksjonene som foregår mellom ionene veldig raske, mens de organiske har mye lavere hastigheter..
Hvis varme produseres i en reaksjon, har en økning i utetemperaturen en tendens til å orientere den i motsatt retning, siden omvendt reaksjon er endoterm (absorberer varme).
På samme måte, hvis et overskudd er forårsaket i en av de reagerende stoffene i et system i likevekt, vil de andre stoffene danne produkter for å nøytralisere nevnte modifisering så mye som mulig..
Som et resultat skifter likevekten favorisering i den ene eller den andre retningen ved å øke reaksjonshastigheten, på en slik måte at verdien av K forblir konstant..
Alle disse ytre påvirkningene og balanseresponsen for å motvirke dem er det som er kjent som Le Chatelier-prinsippet..
applikasjoner
Til tross for den enorme nytteverdien, hadde den ikke den ønskede virkningen eller relevansen i det vitenskapelige samfunnet da denne loven ble foreslått.
Fra det tjuende århundre ble det imidlertid kjent, takket være at britiske forskere William Esson og Vernon Harcourt tok det opp igjen flere tiår etter offentliggjøringen..
Loven om massehandling har hatt mange søknader over tid, hvorav noen er oppført nedenfor:
- Ettersom det er formulert i form av aktiviteter i stedet for konsentrasjoner, er det nyttig å bestemme avvik fra den ideelle oppførselen til reaktanter i en løsning, så lenge det er i samsvar med termodynamikk..
- Når en reaksjon nærmer seg likevekt, kan forholdet mellom nettohastigheten til reaksjonen og den øyeblikkelige Gibbs frie energien til en reaksjon forutsies..
- Når det kombineres med det detaljerte likevektsprinsippet, gir denne loven generelt de resulterende verdiene i henhold til termodynamikken til aktivitetene og konstanten i likevektstilstanden, samt forholdet mellom disse og de resulterende hastighetskonstantene av reaksjoner fremover og reversere retninger.
- Når reaksjonene er av elementær type, får vi ved å anvende denne loven den riktige likevektsligningen for en bestemt kjemisk reaksjon og uttrykkene for hastigheten.
Eksempler på lov om massehandling
-Når man studerer en irreversibel reaksjon mellom ioner som er funnet i løsning, fører det generelle uttrykket for denne loven til Brönsted-Bjerrum-formuleringen, som etablerer forholdet mellom ionestyrken til arten og hastighetskonstanten.
-Når man analyserer reaksjonene som utføres i fortynnede ideelle løsninger eller i en tilstand av gassformet aggregering, oppnås det generelle uttrykket for den opprinnelige loven (tiåret på 80-tallet).
-Ettersom den har universelle egenskaper, kan det generelle uttrykket for denne loven brukes som en del av kinetikken i stedet for å se den som en del av termodynamikken..
-Når den brukes i elektronikk, brukes denne loven til å bestemme at multiplikasjonen mellom tettheten til hullene og elektronene til en gitt overflate har en konstant størrelse i likevektstilstand, selv uavhengig av dopingen som tilføres materialet..
-Bruken av denne loven for å beskrive dynamikken mellom rovdyr og byttedyr er allment kjent, forutsatt at rovdyrsforholdet på byttet presenterer en viss andel med forholdet mellom rovdyr og byttedyr..
-Innen helsestudier kan denne loven til og med brukes til å beskrive visse faktorer for menneskelig atferd, fra politiske og sosiale synspunkter.
Loven om massaksjon i farmakologi
Forutsatt at D er medikamentet og R reseptoren som det virker på, reagerer begge for å stamme fra DR-komplekset, som er ansvarlig for den farmakologiske effekten:
K = [DR] / [D] [R]
K er dissosiasjonskonstanten. Det er en direkte reaksjon der medikamentet virker på reseptoren, og en annen der DR-komplekset dissosieres i de opprinnelige forbindelsene. Hver reaksjon har sin egen hastighet, og tilsvarer seg bare ved likevekt, og tilfredsstiller K.
Ved å tolke masseloven til punkt og prikke, jo høyere konsentrasjon av D, jo høyere konsentrasjon av DR-komplekset dannet..
Imidlertid har totale Rt-mottakere en fysisk grense, så det er ingen ubegrenset mengde R for alle tilgjengelige D. Likeledes har eksperimentelle studier innen farmakologi funnet følgende begrensninger for masseloven på dette feltet:
- Det forutsetter at RD-obligasjonen er reversibel, når det i de fleste tilfeller virkelig ikke er det..
- RD-bindingen kan strukturelt endre noen av de to komponentene (stoffet eller reseptoren), en omstendighet som ikke tar hensyn til masseloven.
- I tillegg blekner masseloven i møte med reaksjoner der flere mellommenn griper inn i dannelsen av RD..
Begrensninger
Loven om massehandling antar at enhver kjemisk reaksjon er av en grunnleggende type; med andre ord at molekylæriteten er den samme som den respektive reaksjonsrekkefølgen for hver art involvert.
Her blir de støkiometriske koeffisientene a, b, c og d betraktet som antall molekyler som er involvert i reaksjonsmekanismen. I en global reaksjon faller disse imidlertid ikke nødvendigvis sammen med deres rekkefølge..
For eksempel for reaksjonen aA + bB <=> cC + dD:
Hastighetsuttrykket for direkte og invers reaksjoner er:
k1= [A]til[B]b
kto= [C]c[D]d
Dette gjelder bare for elementære reaksjoner, siden de globale, selv om de støkiometriske koeffisientene er korrekte, er de ikke alltid reaksjonsordrene. Når det gjelder den direkte reaksjonen, kan sistnevnte være:
k1= [A]w[B]z
I dette uttrykket vil w og z være de virkelige reaksjonsordrene for arter A og B.
Referanser
- Jeffrey Aronson. (2015, 19. november). Livets lover: Guldberg og Waages lov om massehandling. Hentet 10. mai 2018 fra: cebm.net
- ScienceHQ. (2018). Lov om massehandling. Hentet 10. mai 2018 fra: sciencehq.com
- askiitans. (2018). Law of Mass Action and Equilibrium Constant. Hentet 10. mai 2018 fra: askiitians.com
- Salvat Encyclopedia of Sciences. (1968). Kjemi. Volum 9, Salvat S.A. av utgavene Pamplona, Spania. P 13-16.
- Walter J. Moore. (1963). Fysisk kjemi. I Termodynamikk og kjemisk likevekt. (Fjerde utgave). Longmans. P 169.
- Alex Yartsev. (2018). Loven om massaksjon i farmakodynamikk. Hentet 10. mai 2018 fra: derangedphysiology.com



Ingen har kommentert denne artikkelen ennå.