
Ideell gass lov formel og enheter, applikasjoner, eksempler
De ideell gasslov er en tilstandsligning som beskriver et forhold mellom tilstandsfunksjonene assosiert med den ideelle gassen; som temperatur, trykk, volum og antall mol. Denne loven gjør det mulig å studere ekte gassformede systemer ved å sammenligne dem med deres idealiserte versjoner..
En ideell gass er en teoretisk gass, sammensatt av spisse eller sfæriske partikler som beveger seg tilfeldig; med stor kinetisk energi, der det eneste samspillet mellom dem er helt elastiske støt. I tillegg overholder de den ideelle gassloven.

Ved standard trykk og temperatur (STP): 1 atm trykk og en temperatur på 0 ºC, oppfører de fleste av de virkelige gassene seg kvalitativt som ideelle gasser; så lenge tettheten er lav. Store intermolekylære eller interatomære avstander (for edelgasser) letter slike tilnærminger..
Under STP-forhold oppfører oksygen, nitrogen, hydrogen, edelgasser og noen gasser i sammensatt form, slik som karbondioksid, seg som en ideell gass..
Den ideelle gassmodellen har en tendens til å svikte ved lave temperaturer, høyt trykk og høye partikkeltettheter; når intermolekylære interaksjoner, samt partikkelstørrelse, blir viktige.
Den ideelle gassloven er en sammensetning av tre gasslover: Boyle og Mariottes lov, Charles og Gay-Lussacs lov og Avogadros lov..
Artikkelindeks
- 1 Formel og enheter
- 2 Hva etablerer den ideelle gassloven?
- 3 applikasjoner
- 3.1 Beregning av tetthet og molær masse av en gass
- 3.2 Beregning av volumet av en gass produsert i en kjemisk reaksjon
- 3.3 Beregning av partielt trykk av gasser som er tilstede i en blanding
- 3.4 Volum gasser samlet i vann
- 4 Eksempler på beregninger
- 4.1 Øvelse 1
- 4.2 Øvelse 2
- 4.3 Øvelse 3
- 4.4 Øvelse 4
- 5 Referanser
Formel og enheter

Gassloven uttrykkes matematisk med formelen:
PV = nRT
Hvor P er trykket som utøves av en gass. Det uttrykkes vanligvis med enheten av atmosfære (atm), selv om den kan uttrykkes i andre enheter: mmHg, pascal, bar, etc..
Volumet V okkupert av en gass uttrykkes vanligvis i liter liter (L). Samtidig som n er antall mol, R den universelle gasskonstanten, og T temperaturen uttrykt i Kelvin (K).
Det mest brukte uttrykket i gasser for R tilsvarer 0,08206 L atm K-1Muldvarp-1. Selv om SI-enheten for gasskonstanten har en verdi på 8,3145 J mol-1K-1. Begge er gyldige så lenge det er tatt vare på enhetene til de andre variablene (P, T og V).
Den ideelle gassloven er en kombinasjon av Boyle-Mariottes lov, Charles-Gay-Lussacs lov og Avogadros lov.
Boyle-Mariotte lov
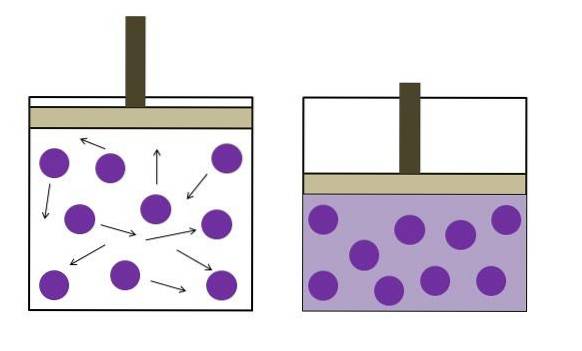
Den ble formulert uavhengig av fysikeren Robert Boyle (1662) og fysikeren og botanikeren Edme Mariotte (1676). Loven er angitt som følger: ved konstant temperatur er volumet av en fast masse av en gass omvendt proporsjonal med trykket den utøver.
PV ∝ k
Ved å bruke et kolon:
P1V1 = PtoVto
Charles-Gay-Lussac-loven

Loven ble utgitt av Gay-Lussac i 1803, men den henviste til det upubliserte arbeidet av Jacques Charles (1787). Av denne grunn er loven kjent som Charles lov..
Loven sier at det ved konstant trykk er en direkte proporsjonal sammenheng mellom volumet okkupert av en gass og dens temperatur.
V ∝ ktoT
Ved å bruke et kolon:
V1/ T1 = Vto/ Tto
V1Tto = VtoT1
Avogadros lov
Loven ble bekjentgjort av Amadeo Avogadro i 1811, og påpekte at like volum av alle gasser, ved samme trykk og temperatur, har samme antall molekyler.
V1/ n1 = Vto/ nto
Hva sier den ideelle gassloven?
Den ideelle gassloven etablerer et forhold mellom fire uavhengige fysiske egenskaper til gass: trykk, volum, temperatur og mengde av gassen. Det er nok å kjenne verdien av tre av dem, for å kunne oppnå verdien av de gjenværende.
Loven fastsetter forholdene som indikerer når en gass oppfører seg ideelt, og når den beveger seg bort fra denne oppførselen.
For eksempel har den såkalte kompresjonsfaktoren (PV / nRT) en verdi på 1 for ideelle gasser. En avvik fra verdien 1 for kompresjonsfaktoren indikerer at gassens oppførsel er langt fra den som er vist med en ideell gass.
Derfor vil det bli gjort en feil når du bruker den ideelle gassligningen på en gass som ikke oppfører seg i henhold til modellen.
applikasjoner
Beregning av tetthet og molær masse av en gass
Den ideelle gasslovligningen kan brukes til å beregne tettheten til en gass og dens molare masse. Ved å gjøre en enkel modifikasjon kan et matematisk uttrykk bli funnet som relaterer tettheten (d) av en gass og dens molare masse (M):
d = MP / RT
Og tømme M:
M = dRT / P
Beregning av volumet av en gass produsert i en kjemisk reaksjon
Støkiometri er grenen av kjemi som relaterer mengden av hver av reaktantene som er tilstede med produktene som deltar i en kjemisk reaksjon, vanligvis uttrykt i mol..
Bruken av den ideelle gassligningen tillater bestemmelse av volumet av en gass produsert i en kjemisk reaksjon; siden antall mol kan oppnås fra den kjemiske reaksjonen. Deretter kan gassens volum beregnes:
PV = nRT
V = nRT / P
Ved å måle V kan utbyttet eller fremdriften av nevnte reaksjon bestemmes. Når det ikke er flere gasser, er det en indikasjon på at reagensene er helt oppbrukt.
Beregning av partialtrykket av gasser som er tilstede i en blanding
Den ideelle gassloven kan brukes, sammen med Daltons lov om partielt trykk, for å beregne partialtrykket til de forskjellige gassene som er tilstede i en gassblanding..
Forholdet gjelder:
P = nRT / V
For å finne trykket til hver av gassene som er tilstede i blandingen.
Volum av gasser samlet i vann
Det utføres en reaksjon som produserer en gass som samles opp ved hjelp av en eksperimentell design i vann. Det totale trykket til gassen pluss vanndamptrykket er kjent. Verdien av sistnevnte kan oppnås i en tabell, og ved subtraksjon kan gassens trykk beregnes.
Fra støkiometrien til den kjemiske reaksjonen kan antall mol gass oppnås, og anvendelse av forholdet:
V = nRT / P
Volumet av produsert gass beregnes.
Beregningseksempler
Øvelse 1
En gass har en tetthet på 0,0847 g / L ved 17 ° C, og et trykk på 760 torr. Hva er molarmassen? Hva er gass??
Vi starter fra ligningen
M = dRT / P
Vi konverterer først temperaturenhetene til kelvin:
T = 17 ºC + 273,15 K = 290,15 K
Og trykket på 760 torr tilsvarer det på 1 atm. Nå trenger du bare å erstatte verdiene og løse:
M = (0,0847 g / L) (0,08206 L atm K-1Muldvarp-1) (290,15 K) / 1 atm
M = 2,016 g / mol
Denne molare massen kan tilsvare en enkelt art: det diatomiske hydrogenmolekylet, Hto.
Øvelse 2
En masse på 0,00553 g kvikksølv (Hg) i gassfasen finnes i et volum på 520 L, og ved en temperatur på 507 K. Beregn trykket som utøves av Hg. Molmassen til Hg er 200,59 g / mol.
Problemet løses ved å bruke ligningen:
PV = nRT
Informasjon om antall mol Hg vises ikke; men de kan fås ved hjelp av deres molare masse:
Antall mol Hg = (0,00553 g Hg) (1 mol Hg / 200,59 g)
= 2757 10-5 føflekker
Nå må vi bare løse for P og erstatte verdiene:
P = nRT / V
= (2757 10-5 mol) (8,20610-to L atm K-1Muldvarp-1) (507 K) / 520 l
= 2,2 10-6 minibank
Øvelse 3
Beregn trykket som genereres av saltsyren produsert ved å reagere 4,8 g klorgass (Clto) med hydrogengass (Hto), i et volum på 5,25 L, og ved en temperatur på 310 K. Molmassen til Clto er 70,9 g / mol.
H2 g) + Cl2 g) → 2 HC1(g)
Problemet løses ved å bruke den ideelle gassligningen. Men mengden HC1 uttrykkes i gram og ikke i mol, så riktig transformasjon er gjort.
Mol HCl = (4,8 g Clto) (1 mol Clto/ 70,9 g Clto) (2 mol HCl / 1 mol Clto)
= 0,135 mol HC1
Bruke den ideelle gasslovligningen:
PV = nRT
P = nRT / V
= (0,135 mol HC1) (0,08206 L atm K-1Muldvarp-1) (310 K) / 5,25 l
= 0,65 atm
Øvelse 4
En 0,130 g prøve av en gassformig forbindelse opptar et volum på 140 ml ved en temperatur på 70 ° C og et trykk på 720 torr. Hva er dens molare masse??
For å bruke den ideelle gassligningen, må det først gjøres flere endringer:
V = (140 ml) (1 L / 1000 ml)
= 0,14 L.
Tar vi volumet i liter, må vi nå uttrykke temperaturen i kelvin:
T = 70 ºC + 273,15 K = 243,15 K
Og til slutt må vi konvertere trykket i atmosfærenheter:
P = (720 torr) (1 atm / 760 torr)
= 0,947 atm
Det første trinnet i å løse problemet er å oppnå antall mol av forbindelsen. For dette brukes den ideelle gassligningen og vi løser for n:
PV = nRT
n = PV / RT
= (0,947 atm) (0,14 L) / (0,08206 L atm K-1Muldvarp-1) (243,15 K)
= 0,067 mol
Du trenger bare å beregne molarmassen ved å dele gramene med molene som er oppnådd:
Molmasse = gram forbindelse / antall mol.
= 0,130 g / 0,067 mol
= 19,49 g / mol
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). CENGAGE Læring.
- Ira N. Levine. (2014). Prinsipper for fysisk-kjemi. Sjette utgave. Mc Graw Hill.
- Glasstone. (1970). Avhandling om fysisk kjemi. Andre utgave. Aguilar.
- Mathews, C. K., Van Holde, K. E., og Ahern, K. G. (2002). Biokjemi. 3det var Utgave. Utgiver Pearson Addison Wesley.
- Wikipedia. (2019). Ideell gass. Gjenopprettet fra: en.wikipedia.org
- Redaksjonelt team. (2018). Boyles lov eller Boyle-Mariottes lov | Lov om gasser. Gjenopprettet fra: iquimicas.com



Ingen har kommentert denne artikkelen ennå.