
Heisenberg atommodell

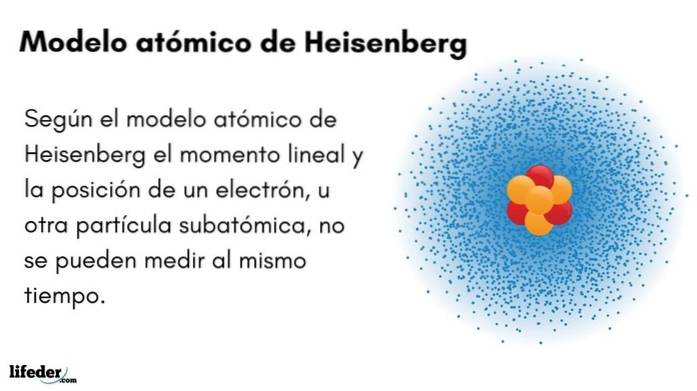
Hva er Heisenbergs atommodell?
De Heisenberg atommodell (1927) introduserer usikkerhetsprinsippet i elektronorbitalene som omgir atomkjernen. Den fremtredende tyske fysikeren la grunnlaget for kvantemekanikken for å estimere oppførselen til de subatomære partiklene som utgjør et atom.
Werner Heisenbergs usikkerhetsprinsipp indikerer at det ikke er mulig å vite med sikkerhet posisjonen og det lineære momentet til et elektron samtidig. Det samme prinsippet gjelder variablene tid og energi; hvis vi har en anelse om posisjonen til elektronet, vil vi ikke kjenne elektronets lineære momentum, og omvendt.
Kort fortalt er det ikke mulig å forutsi verdien av begge variablene samtidig. Det foregående innebærer ikke at noen av de nevnte mengdene ikke kan være nøyaktig kjent. Så lenge det er separat, er det ingen hindring for å oppnå renteverdien.
Usikkerhet oppstår imidlertid når det gjelder å vite to konjugerte størrelser samtidig, som posisjon og lineær momentum, og tid sammen med energi..
Dette prinsippet oppstår på grunn av en strengt teoretisk resonnement, som den eneste levedyktige forklaringen som gir grunn til vitenskapelige observasjoner.
Kjennetegn ved atommodellen Heisenberg

I mars 1927 ga Heisenberg ut sitt arbeid Om det perseptuelle innholdet av kinematikk og kvanteteoretisk mekanikk, der du detaljerte usikkerhets- eller ubestemmelsesprinsippet.
Dette prinsippet, grunnleggende i atommodellen foreslått av Heisenberg, er preget av følgende:
- Usikkerhetsprinsippet dukker opp som en forklaring som utfyller de nye atomteoriene om elektroners oppførsel. Til tross for bruk av måleinstrumenter med høy presisjon og sensitivitet, er ubestemmelighet fremdeles til stede i enhver eksperimentell test.
- På grunn av usikkerhetsprinsippet, når du analyserer to relaterte variabler, hvis du har nøyaktig kunnskap om en av disse, vil usikkerheten om verdien til den andre variabelen være større og større..
- Momentet og posisjonen til et elektron, eller annen subatomær partikkel, kan ikke måles samtidig.
- Forholdet mellom begge variablene er gitt av en ulikhet. Ifølge Heisenberg er produktet av variasjonene av det lineære momentet og partikkelens posisjon alltid større enn kvoten mellom plankkonstanten (6.62606957 (29) × 10 -3. 4 Jules x sekunder) og 4π, som beskrevet i følgende matematiske uttrykk:

Legenden som tilsvarer dette uttrykket er følgende:
∆p: ubestemmelighet av det lineære øyeblikket.
∆x: ubestemt posisjon.
h: Planken er konstant.
π: tall pi 3.14.
- I lys av det ovennevnte har usikkerhetsproduktet som en nedre grense forholdet h / 4π, som er en konstant verdi. Derfor, hvis en av størrelsene har en tendens til null, må den andre øke i samme andel.
- Dette forholdet gjelder for alle par konjugerte kanoniske størrelser. For eksempel: Heisenbergs usikkerhetsprinsipp er perfekt anvendelig for energitidsparet, som beskrevet nedenfor:
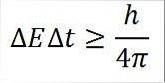
I dette uttrykket:
∆E: ubestemmelighet av energi.
∆t: tidsbestemthet.
h: Planken er konstant.
π: tall pi 3.14.
- Fra denne modellen følger det at absolutt kausal determinisme i konjugerte kanoniske variabler er umulig, siden man skal ha kunnskap om de opprinnelige verdiene til studievariablene for å etablere dette forholdet..
- Derfor er Heisenberg-modellen basert på sannsynlighetsformuleringer, på grunn av tilfeldigheten som eksisterer mellom variablene på subatomære nivåer..
Eksperimentelle tester
Usikkerhetsprinsippet Heisenberg fremstår som den eneste mulige forklaringen på eksperimentelle tester som fant sted i løpet av de første tre tiårene av det 21. århundre..
Før Heisenberg fortalte usikkerhetsprinsippet, antydet forskriftene som gjaldt på det tidspunktet at variablene lineært momentum, posisjon, vinkelmoment, tid, energi, blant annet for subatomære partikler, ble definert operasjonelt.
Dette betydde at de ble behandlet som om de var klassisk fysikk; det vil si at en startverdi ble målt og den endelige verdien ble estimert i henhold til den forhåndsinnstilte prosedyren.
Dette innebar å definere et referansesystem for målinger, måleinstrumentet og måten å bruke instrumentet på, i samsvar med den vitenskapelige metoden..
Følgelig måtte variablene beskrevet av subatomære partikler oppføre seg på en deterministisk måte. Det vil si at dens oppførsel måtte forutsies nøyaktig og presist..
Hver gang en test av denne typen ble utført, var det imidlertid umulig å oppnå den teoretisk estimerte verdien i målingen..
Målingene ble forvrengt på grunn av de naturlige forholdene i eksperimentet, og resultatet oppnådd var ikke nyttig for å berike atomteorien.
Eksempel
For eksempel: hvis det er et spørsmål om å måle hastigheten og posisjonen til et elektron, må oppsettet av eksperimentet tenke på kollisjonen mellom en lysfoton og elektronet.
Denne kollisjonen induserer en variasjon i hastigheten og den indre posisjonen til elektronet, som målingen blir endret med ved eksperimentelle forhold..
Derfor oppfordrer forskeren forekomsten av en uunngåelig eksperimentell feil, til tross for nøyaktigheten og presisjonen til instrumentene som brukes..
Kvantemekanikk enn klassisk mekanikk
I tillegg til det ovennevnte sier Heisenbergs ubestemmelsesprinsipp at kvantemekanikken per definisjon fungerer annerledes enn klassisk mekanikk.
Følgelig antas det at presis kunnskap om målinger på subatomært nivå er begrenset av den fine linjen som skiller klassisk og kvantemekanikk..
Begrensninger i Heisenberg-modellen
Til tross for å forklare ubestemmeligheten til subatomære partikler og etablere forskjellene mellom klassisk og kvantemekanikk, etablerer Heisenbergs atommodell ikke en eneste ligning for å forklare tilfeldigheten til denne typen fenomener..
Videre innebærer det faktum at forholdet er etablert gjennom en ulikhet at spekteret av muligheter for produktet av to konjugerte kanoniske variabler er ubestemt. Følgelig er usikkerheten som ligger i subatomære prosesser betydelig..
Artikler av interesse
Schrödingers atommodell.
Atomic de Broglie-modellen.
Chadwick Atomic Model.
Perrins atommodell.
Thomsons atommodell.
Dalton atommodell.
Dirac Jordan atommodell.
Atomic model of Democritus.
Atomisk modell av Leucippus.
Bohr atommodell.
Sommerfeld atommodell.
Nåværende atommodell.
Referanser
- Beyler, R. (1998). Werner Heisenberg. Encyclopædia Britannica, Inc. Gjenopprettet fra: britannica.com
- The Heisenberg Usikkerhetsprinsipp (s.f.). Gjenopprettet fra: hiru.eus
- García, J. (2012). Heisenbergs usikkerhetsprinsipp. Gjenopprettet fra: hiberus.com
- Atomic modeller (s.f.). Det nasjonale autonome universitetet i Mexico. Mexico DF, Mexico. Gjenopprettet fra: asesorias.cuautitlan2.unam.mx
- Werner Heisenberg (s.f.) Gjenopprettet fra: the-history-of-the-atom.wikispaces.com
- Wikipedia, The Free Encyclopedia (2018). Planken er konstant. Gjenopprettet fra: es.wikipedia.org
- Wikipedia, The Free Encyclopedia (2018). Heisenbergs ubestemmelsesforhold. Gjenopprettet fra: es.wikipedia.org


Ingen har kommentert denne artikkelen ennå.