
Karakteristiske apolare molekyler, identifikasjon og eksempler
De apolare molekyler er de som presenterer i sin struktur en symmetrisk fordeling av elektronene sine. Dette er mulig hvis elektronegativitetsforskjellen til deres atomer er liten, eller hvis de elektronegative atomer eller grupper vektors avbryter deres effekter på molekylet..
Ikke alltid er "apolaritet" absolutt. Av denne grunn blir molekyler med lav polaritet noen ganger betraktet som apolare; det vil si at det har et dipolmoment µ nær 0. Her går vi inn i feltet til den pårørende: hvor lav må µ være for at et molekyl eller en forbindelse skal betraktes som ikke-polær??
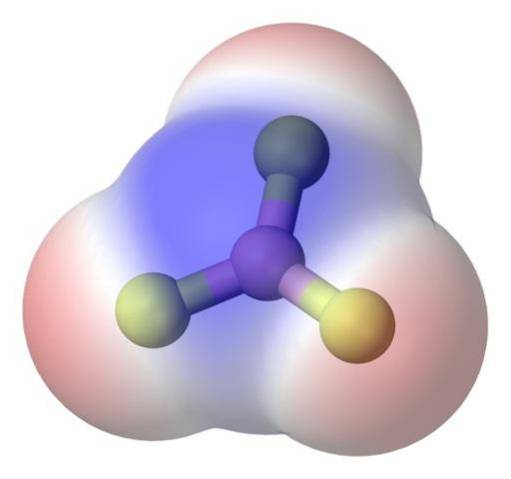
For bedre å løse problemet er det bor-trifluoridmolekylet, BF3 (toppbilde).
Fluoratomet er mye mer elektronegativt enn boratomet, og derfor er B-F bindingene polare. Imidlertid BF-molekylet3 er symmetrisk (trigonalplan) og involverer vektorkansellering av de tre øyeblikkene B-F.
Dermed genereres også apolare molekyler, selv med eksistensen av polare bindinger. Den genererte polariteten kan balanseres ved at det eksisterer en annen polar lenke, av samme størrelse som den forrige, men orientert i motsatt retning; slik det skjer i BF3.
Artikkelindeks
- 1 Kjennetegn ved et apolært molekyl
- 1.1 Symmetri
- 1.2 Elektronegativitet
- 1.3 Intermolekylære krefter
- 2 Hvordan identifisere dem?
- 3 eksempler
- 3.1 Edelgasser
- 3.2 Diatomiske molekyler
- 3.3 Hydrokarboner
- 3.4 Andre
- 4 Referanser
Kjennetegn ved et apolært molekyl
Symmetri
For at effekten av polare bindinger skal eliminere hverandre, må molekylet ha en viss geometrisk struktur; f.eks. lineær, den letteste å forstå ved første øyekast.
Dette er tilfellet med karbondioksid (COto), som har to polare bindinger (O = C = O). Dette er fordi de to dipolmomentene til C = O-bindingene avbrytes når den ene er orientert mot den ene siden, og den andre mot den andre, i en vinkel på 180 °..
Derfor er en av de første egenskapene som må tas i betraktning når man vurderer "apolariteten" til et molekyl fra et fugleperspektiv, å observere hvor symmetrisk det er..
Anta at i stedet for COto vi har COS-molekylet (O = C = S), kalt karbonylsulfid.
Nå er det ikke lenger et apolært molekyl, siden svovelens elektronegativitet er mindre enn oksygen; og derfor er dipolmomentet C = S forskjellig fra det for C = O. Som et resultat er COS et polært molekyl (hvor polar er en annen sak).
Bildet nedenfor oppsummerer grafisk alt nettopp beskrevet:
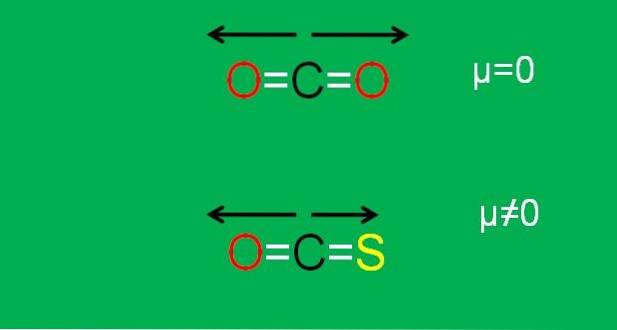
Merk at dipolmomentet til C = S-bindingen er mindre enn C = O-bindingen i COS-molekylet.
Elektronegativitet
Elektronegativitet på Pauling-skalaen har verdier mellom 0,65 (for francium), og 4,0 (for fluor). Generelt har halogener høy elektronegativitet.
Når forskjellen i elektronegativitet til elementene som danner en kovalent binding er mindre enn eller lik 0,4, sies det å være ikke-polær eller ikke-polær. Imidlertid er de eneste molekylene som virkelig er apolare, dannet av bindinger mellom identiske atomer (som hydrogen, H-H)..
Intermolekylære krefter
For at et stoff skal oppløses i vann må det samhandle elektrostatisk med molekylene; interaksjoner som apolare molekyler ikke kan utføre.
I apolare molekyler er deres elektriske ladninger ikke begrenset til den ene enden av molekylet, men er symmetrisk (eller homogent) fordelt. Derfor er det ikke i stand til å samhandle med dipol-dipol krefter.
I stedet samhandler apolare molekyler med hverandre gjennom Londons spredningskrefter; Dette er øyeblikkelige dipoler som polariserer den elektroniske skyen til atomene i nærliggende molekyler. Her er molekylmassen en dominerende faktor i de fysiske egenskapene til disse molekylene..
Hvordan identifisere dem?
-Kanskje en av de beste metodene for å identifisere et apolært molekyl, er dets løselighet i forskjellige polare løsningsmidler, og er generelt dårlig løselig i dem..
-Generelt har apolare molekyler gassform. De kan også være å danne ublandbare væsker med vann.
-Ikke-polare faste stoffer kjennetegnes ved å være myke.
-Dispersjonskreftene som holder dem sammen er generelt svake. På grunn av dette har deres smelte- eller kokepunkt en tendens til å være lavere enn for forbindelser av polær natur..
-Ikke-polare molekyler, spesielt i flytende form, er dårlige ledere av elektrisitet, siden de mangler en netto elektrisk ladning..
Eksempler
Edelgasser
Selv om de ikke er molekyler, anses edelgasser som apolare. Hvis det antas at to av atomene, He-He, samhandler i korte perioder, kan interaksjonen betraktes (halvparten) som et molekyl; molekyl som ville være apolar i naturen.
Diatomiske molekyler
Diatomiske molekyler, slik som Hto, BRto, jegto, Clto, Oto, og Fto, de er apolar. Disse har den generelle formelen A.to, A-A.
Hydrokarboner
Hva om A var en gruppe atomer? Det ville være før andre apolære forbindelser; for eksempel etan, CH3-CH3, hvis karbonskjelett er lineært, C-C.
Metan, CH4, og etan, CtoH6, de er apolare molekyler. Karbon har en elektronegativitet på 2,55; mens elektronegativiteten til hydrogen er 2,2. Derfor er det en dipolvektor med lav intensitet, orientert fra hydrogen mot karbon..
Men på grunn av den geometriske symmetrien til metan- og etanmolekylene, er summen av dipolvektorene eller dipolmomentene i molekylene deres null, så det er ingen nettolading på molekylene..
Generelt skjer det samme med alle hydrokarboner, og selv når det er umettninger i dem (dobbelt- og trippelbindinger), betraktes de som ikke-polære eller lavpolaritetsforbindelser. Sykliske hydrokarboner er også apolare molekyler, slik som cykloheksan eller cyklobutan.
Andre
Molekyler av karbondioksid (COto) og karbondisulfid (CSto) er apolare molekyler, begge med lineær geometri.
I karbondisulfid er elektronegativiteten til karbon 2,55, mens elektronegativiteten til svovel er 2,58; så begge elementene har praktisk talt samme elektronegativitet. Det er ingen generering av en dipolvektor, og nettoladningen er derfor null.
På samme måte har vi følgende CCl-molekyler4 og AlBr3, begge apolar:
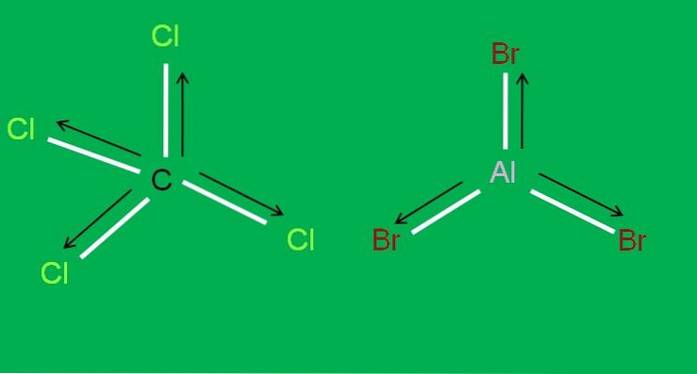
I aluminiumtribromid, AlBr3 det samme skjer med BF3, i begynnelsen av artikkelen. I mellomtiden, for karbontetraklorid, CCl4, geometrien er tetrahedral og symmetrisk, siden alle C-Cl-bindinger er like.
Tilsvarende molekyler med den generelle formelen CX4 (CF4, CI4 og CBr4), de er også apolare.
Og til slutt kan et apolært molekyl til og med ha oktaedrisk geometri, slik det er tilfelle med svovelheksafluorid, SF6. Faktisk kan den ha hvilken som helst geometri eller struktur, så lenge den er symmetrisk og den elektroniske distribusjonen er homogen..
Referanser
- Carey F. A. (2008). Organisk kjemi. Karboksylsyrer. (Sjette utgave). Mc Graw Hill.
- Cedrón J., Landa V., Robles J. (2011). Molekylær polaritet. Gjenopprettet fra: corinto.pucp.edu.pe
- Veiledervisning. (2018). Ikke-polært molekyl. Gjenopprettet fra: chemistry.tutorvista.com
- Helmenstine, Anne Marie, Ph.D. (28. januar 2019). Eksempler på polære og ikke-polare molekyler. Gjenopprettet fra: thoughtco.com
- Kurtus R. (19. september 2016). Polare og ikke-polære molekyler. Skole for mestere. Gjenopprettet fra: school-for-champions.com
- Ganong W. (2004). Medisinsk fysiologi. Utgave 19Th. Redaksjonell den moderne manualen.



Ingen har kommentert denne artikkelen ennå.