
Formler for Carnot-maskiner, hvordan det fungerer og applikasjoner

De carnot-maskin det er en ideell syklisk modell der varme brukes til å utføre arbeid. Systemet kan forstås som et stempel som beveger seg inne i en sylinder som komprimerer en gass. Syklusen som utøves er den av Carnot, bekjentgjort av faren til termodynamikken, den franske fysikeren og ingeniøren Nicolas Léonard Sadi Carnot..
Carnot bekjente denne syklusen tidlig på 1800-tallet. Maskinen utsettes for fire tilstandsvariasjoner, vekslende forhold som temperatur og konstant trykk, der en variasjon av volumet er påvist når du komprimerer og utvider gassen.
Artikkelindeks
- 1 Formler
- 1.1 Isoterm ekspansjon (A → B)
- 1.2 Adiabatisk utvidelse (B → C)
- 1.3 Isoterm kompresjon (C → D)
- 1.4 Adiabatisk kompresjon (D → A)
- 2 Hvordan fungerer Carnot-maskinen?
- 3 applikasjoner
- 4 Referanser
Formler
Ifølge Carnot er det mulig å maksimere den oppnådde ytelsen når den ideelle maskinen utsettes for variasjoner i temperatur og trykk.
Carnot-syklusen må analyseres separat i hver av sine fire faser: isoterm ekspansjon, adiabatisk ekspansjon, isoterm kompresjon og adiabatisk kompresjon..
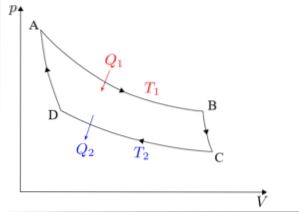
Formlene knyttet til hver av fasene i syklusen som utføres i Carnots maskin vil bli beskrevet nedenfor..
Isoterm ekspansjon (A → B)
Premissene for denne fasen er følgende:
- Gassvolum: går fra minimumsvolum til middels volum.
- Maskintemperatur: konstant temperatur T1, høy verdi (T1> T2).
- Maskintrykk: synker fra P1 til P2.
Den isotermiske prosessen innebærer at temperaturen T1 ikke varierer i løpet av denne fasen. Varmeoverføring induserer gassutvidelse, som induserer bevegelse på stempelet og produserer mekanisk arbeid.
Når gassen utvider seg, har den en tendens til å avkjøles. Imidlertid absorberer den varmen fra temperaturkilden, og under utvidelsen opprettholder den konstant temperatur..
Siden temperaturen forblir konstant under denne prosessen, endres ikke den indre energien til gassen, og all varmen som absorberes av gassen blir effektivt transformert til arbeid. A) Ja:
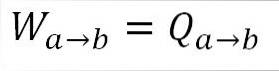
På slutten av denne fasen av syklusen er det også mulig å oppnå trykkverdien ved hjelp av den ideelle gassligningen. Dermed har vi følgende:
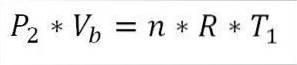
I dette uttrykket:
Pto: Trykk på slutten av fasen.
Vb: Volum ved punkt b.
n: Antall mol gass.
A: Universell konstant av ideelle gasser. R = 0,082 (atm * liter) / (mol * K).
T1: Innledende absolutt temperatur, grader Kelvin.
Adiabatisk utvidelse (B → C)
I løpet av denne fasen av prosessen skjer gassekspansjon uten behov for utveksling av varme. Lokalene er således beskrevet nedenfor:
- Gassvolum: går fra middels volum til maksimalt volum.
- Maskintemperatur: synker fra T1 til T2.
- Maskintrykk: konstant trykk P2.
Den adiabatiske prosessen innebærer at trykket P2 ikke varierer i løpet av denne fasen. Temperaturen synker og gassen fortsetter å utvide seg til den når sitt maksimale volum; stempelet når stoppen.
I dette tilfellet kommer arbeidet som er gjort fra gassens indre energi, og verdien er negativ fordi energien avtar i løpet av denne prosessen..
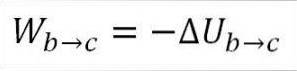
Forutsatt at det er en ideell gass, mener teorien at gassmolekyler bare har kinetisk energi. I henhold til prinsippene for termodynamikk kan dette utledes av følgende formel:
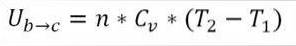
I denne formelen:
∆Ub → c: Variasjon av indre energi av den ideelle gassen mellom punktene b og c.
n: Antall mol gass.
Cv: Molar varmekapasitet for gass.
T1: Innledende absolutt temperatur, grader Kelvin.
T2: Absolutt sluttemperatur, grader Kelvin.
Isoterm kompresjon (C → D)
I denne fasen begynner kompresjonen av gassen; det vil si at stempelet beveger seg inn i sylinderen, som gassen trekker sammen volumet med.
Betingelsene som ligger i denne fasen av prosessen er beskrevet nedenfor:
- Gassvolum: går fra maksimalt volum til mellomvolum.
- Maskintemperatur: konstant temperatur T2, redusert verdi (T2 < T1).
- Maskintrykk: øker fra P2 til P1.
Her øker trykket på gassen, så den begynner å komprimere. Imidlertid forblir temperaturen konstant, og derfor er variasjonen av gassens indre energi null.
Analogt med isotermisk ekspansjon er utført arbeid lik varmen i systemet. A) Ja:
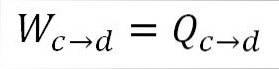
Det er også mulig å finne trykket på dette punktet ved hjelp av den ideelle gassligningen.
Adiabatisk kompresjon (D → A)
Det er den siste fasen av prosessen, der systemet går tilbake til de opprinnelige forholdene. For dette vurderes følgende forhold:
- Gassvolum: går fra et mellomvolum til et minimumsvolum.
- Maskintemperatur: øker fra T2 til T1.
- Maskintrykk: konstant trykk P1.
Varmekilden som ble innlemmet i systemet i forrige fase fjernes, slik at den ideelle gassen vil øke temperaturen så lenge trykket forblir konstant..
Gassen går tilbake til de opprinnelige temperaturforholdene (T1) og til volumet (minimum). Nok en gang kommer arbeidet som er gjort fra gassens indre energi, så du må:
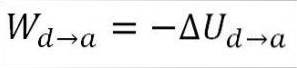
I likhet med tilfellet med adiabatisk utvidelse, er det mulig å oppnå variasjonen av gassenergien ved hjelp av følgende matematiske uttrykk:
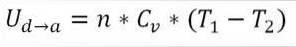
Hvordan fungerer Carnot-maskinen?
Carnot-motoren fungerer som en motor der ytelsen maksimeres ved å variere isotermiske og adiabatiske prosesser, alternerende utvidelses- og kompresjonsfasene til en ideell gass..
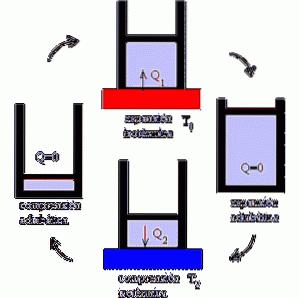
Mekanismen kan forstås som en ideell enhet som utfører arbeid som blir utsatt for varmevariasjoner, gitt eksistensen av to temperaturkilder.
I det første fokuset blir systemet utsatt for en temperatur T1. Det er en høy temperatur som gir stress på systemet og får gassen til å ekspandere..
I sin tur oversettes dette til utførelse av et mekanisk arbeid som tillater mobilisering av stempelet ut av sylinderen, og hvis stopp bare er mulig gjennom adiabatisk utvidelse.
Deretter kommer det andre fokuset, der systemet utsettes for en temperatur T2, lavere enn T1; det vil si at mekanismen utsettes for avkjøling.
Dette induserer ekstraksjon av varme og knusing av gassen, som når sitt opprinnelige volum etter adiabatisk kompresjon..
applikasjoner
Carnot-maskinen har blitt brukt mye takket være dens bidrag til å forstå de viktigste aspektene ved termodynamikk.
Denne modellen gir en klar forståelse av variasjonene av ideelle gasser som er underlagt endringer i temperatur og trykk, noe som gjør den til en referansemetode når du designer ekte motorer..
Referanser
- Carnot Heat Engine Cycle and the 2nd Law (s.f.). Gjenopprettet fra: nptel.ac.in
- Castellano, G. (2018). Carnot-maskin. Gjenopprettet fra: famaf.unc.edu.ar
- Carnot syklus (s.f.) Ecured. Havana Cuba. Gjenopprettet fra: ecured.cu
- Carnot-syklusen (s.f.). Gjenopprettet fra: sc.ehu.es
- Fowler, M. (s.f.). Varmemotorer: Carnot-syklusen. Gjenopprettet fra: galileo.phys.virginia.edu
- Wikipedia, The Free Encyclopedia (2016). Carnot maskin. Gjenopprettet fra: es.wikipedia.org


Ingen har kommentert denne artikkelen ennå.