
Kalsiumnitrat (Ca (NO3) 2) struktur, egenskaper og bruksområder

De kalsiumnitrat er et tertiært uorganisk salt hvis kjemiske formel er Ca (NO3)to. Fra formelen er det kjent at dets faste stoff består av Ca-ionerto+ og nei3- i forholdet 1: 2. Derfor er det en forbindelse av rent ionisk natur..
En av egenskapene er dens oksiderende karakter på grunn av nitratanionet. Det er ikke brennbart, det vil si at det ikke brenner ved høye temperaturer. Å være ikke-brennbar, representerer det et trygt solid å håndtere uten mye pleie; det kan imidlertid akselerere antenningen av brennbare materialer.

Utseendet består av et granulært fast stoff som har en hvit eller lys grå farge (øvre bilde). Det kan være vannfritt eller tetrahydrat, Ca (NO3)to4HtoO. Det er veldig løselig i vann, metanol og aceton.
Kalsiumnitrat har blitt mye brukt som gjødsel, da det beveger seg lett i fuktig jord, og absorberes raskt av planterøttene. Tilbyr to viktige elementer for planteernæring og vekst: nitrogen og kalsium.
Nitrogen er et av de tre essensielle elementene for utvikling av planter (N, P og K), det er essensielt i syntesen av proteiner. I mellomtiden er kalsium nødvendig for å opprettholde strukturen til plantecelleveggen. Av denne grunn Ca (NO3)to mye går til hager.
På den annen side har dette saltet toksiske virkninger, spesielt ved direkte kontakt med huden og øynene, samt ved å inhalere støvet. I tillegg kan den spaltes ved oppvarming.
Artikkelindeks
- 1 Struktur av kalsiumnitrat
- 2 Fysiske og kjemiske egenskaper
- 2.1 Kjemiske navn
- 2.2 Molekylformel
- 2.3 Molekylvekt
- 2.4 Fysisk utseende
- 2.5 Kokepunkt
- 2.6 Smeltepunkt
- 2.7 Løselighet i vann
- 2.8 Løselighet i organiske løsningsmidler
- 2.9 Surhet (pKa)
- 2.10 Tetthet
- 2.11 Nedbrytning
- 2.12 Reaktiv profil
- 3 bruksområder
- 3.1 Jordbruk
- 3.2 Betong
- 3.3 Rensing av avløps- eller avløpsvann
- 3.4 Å lage kalde kompresser
- 3.5 Latex koagulasjon
- 3.6 Varmeoverføring og lagring
- 4 Søknadsformer
- 5 Referanser
Struktur av kalsiumnitrat
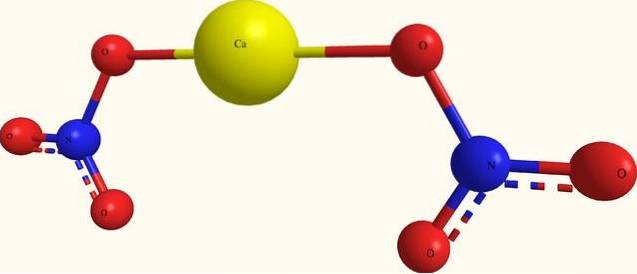
Det øvre bildet viser strukturen til Ca (NO3)to i en modell av kuler og stenger. Her er det imidlertid en feil: det antas at det eksisterer kovalente Ca-O-bindinger, som motsier deres ioniske karakter. For å tydeliggjøre dette, er virkelig interaksjonene av elektrostatisk type.
Kationet Cato+ omgir seg selv med to INGEN anioner3- i henhold til proporsjonene på glasset. Derfor dominerer nitrogen i form av nitrat i den krystallinske strukturen..
Ionene er gruppert på en slik måte at de etablerer en konfigurasjon hvis minimumsuttrykk er enhetscellen; som for det vannfrie saltet er kubisk. Det vil si at fra kuber som inneholder forholdet 1: 2 for disse ionene, blir hele krystallet reprodusert.
På den annen side er tetrahydratsaltet, Ca (NO3)to4HtoEller den har fire vannmolekyler for hvert sett NO3- ACto+ IKKE3-. Dette modifiserer krystallstrukturen og deformerer den til en monoklinisk enhetscelle..
Derfor forventes krystallene for både de vannfrie og tetrahydrat-saltene å være forskjellige; forskjeller som kan bestemmes i deres fysiske egenskaper, for eksempel smeltepunkter.
Fysiske og kjemiske egenskaper
Kjemiske navn
-Kalsiumnitrat
-Kalsiumdinitrat
-Nitrocalcite
-Norsk salpeter og limesaltpetro.
Molekylær formel
Tut3)to eller CaNtoELLER6
Molekylær vekt
Vannfri 164,088 g / mol og tetrahydrat 236,15 g / mol. Legg merke til effekten av vann på molekylvekten, og den kan ikke overses når du veier den..
Fysisk utseende
Hvitt eller lysegrått fast stoff eller granulat. Kubiske hvite krystaller eller delikserende granulater; det vil si at de absorberer fuktighet til det punktet at de oppløses som et resultat av deres høye løselighet.
Kokepunkt
Den vannfrie formen spaltes ved oppvarming til en temperatur som forhindrer bestemmelse av kokepunktet; mens tetrahydratformen av saltet har et kokepunkt på 132 ºC (270 ºF, 405 K).
Smeltepunkt
-Vannfri form: 561 ° C til 760 mmHg (1042 ° F, 834 K).
-Tetrahydratform: 42,7 ° C (109 ° F, 316 K).
Dette viser hvordan vannmolekyler forstyrrer elektrostatiske interaksjoner mellom Cato+ og nei3- inne i krystallene; og følgelig smelter det faste stoffet ved en mye lavere temperatur.
Vannløselighet
-Vannfri form: 1212 g / L ved 20 ºC.
-Tetrahydratform: 1290 g / L ved 20 ºC.
Vannet i krystallene øker neppe saltets løselighet.
Løselighet i organiske løsningsmidler
-I etanol 51,42 g / 100 g ved 20 ° C.
-I metanol, 134 g / 100 g ved 10 ° C.
-I aceton, 168 g / 100 g ved 20 ° C.
Surhet (pKa)
6.0
Tetthet
2,5 g / cm3 ved 25 ºC (tetrahydrat).
Nedbrytning
Når kalsiumnitrat oppvarmes til glødelement, spaltes det i kalsiumoksid, nitrogenoksid og oksygen..
Reaktiv profil
Det er et sterkt oksidasjonsmiddel, men det er ikke brennbart. Akselererer antenningen av brennbare materialer. Inndelingen av kalsiumnitrat i fine partikler, letter eksplosjonen når forbindelsen utsettes for langvarig brann.
Blandinger med alkylestere blir eksplosive ved å opprette alkylnitratestere. Kombinasjonen av kalsiumnitrat med fosfor, tinn (II) klorid eller annet reduksjonsmiddel, kan reagere eksplosivt.
applikasjoner
jordbruk
Den brukes i avlinger som kilde til nitrogen og kalsium. Kalsiumnitrat er veldig løselig i vann og absorberes lett av planterøttene. I tillegg forsurer den ikke jord fordi ionene ikke kan hydrolyseres betydelig..
Blanding med gjødsel som inneholder fosfor eller sulfat bør unngås for å unngå dannelse av uoppløselige salter. På grunn av hygroskopisiteten bør den oppbevares i et tørt og kjølig miljø.
Bruken av den har en fordel i forhold til bruk av ammoniumnitrat som gjødsel. Selv om denne siste forbindelsen bidrar med nitrogen til planter, forstyrrer den kalsiumabsorpsjonen, noe som kan føre til kalsiummangel i planter..
Kalsium bidrar til vedlikehold av celleveggstrukturen til planter. I nærvær av kalsiummangel viser det voksende vevet av planter, som rotspisser, unge blader og skuddspisser, forvrengt vekst..
Redusert ammoniakk
Kalsiumnitrat reduserer akkumulering av flyktige fettsyrer og fenolforbindelser, fytotoksisk som akkumuleres på grunn av nedbrytning av rester av soyabønner..
I tillegg er det en tendens til at kalsiumnitrat reduserer ammoniumkonsentrasjonen i jorda, noe som øker hydrogenbufferkapasiteten..
Betong
Kalsiumnitrat brukes til å redusere betongens herdetid. Dette produseres ved generering av kalsiumhydroksid, kanskje gjennom en dobbelt fortrengningsreaksjon..
I tillegg induserer kalsiumnitrat dannelsen av jernhydroksydforbindelsen, hvis beskyttende virkning på betong reduserer korrosjonen. Det vil si at tilstedeværende jern kan reagere med de grunnleggende komponentene i betong, slik som kalsiumhydroksyd i seg selv..
Kalsiumnitrat reduserer herdetiden, så vel som motstanden til betongen som vulkansk aske er tilsatt. For å studere effekten av tilsetning av kalsiumnitrat til betong, har økende konsentrasjoner av kalsiumnitrat blitt brukt, mellom 2% og 10%..
En større reduksjon i herdetid er observert, samt en økning i betongstyrke ettersom kalsiumnitratkonsentrasjonen økte opp til 10%.
Kloakk- eller avløpsrensing
Kalsiumnitrat brukes til å redusere lukt fra kloakk ved å redusere genereringen av hydrogensulfid. I tillegg forbrukes det organiske materialet som genererer anaerobe forhold, noe som gjør det vanskelig for mange biologiske arter å overleve..
Å lage kalde kompresser
Kalsiumnitrattetrahydrat er en endoterm forbindelse, det vil si at den har evnen til å absorbere varme fra omgivelsene. Dette gir en avkjøling av kroppene som kommer i kontakt med beholderne som inneholder den..
Kompressene øker temperaturen, og for å regenerere dem er det nok å plassere dem i en fryser
Latex koagulasjon
Kalsiumnitrat brukes i latexkoagulasjonsfasen. Det er en del av nedsenkningsløsningen, og når den kommer i kontakt med løsningen som inneholder latex, bryter den stabiliseringen og forårsaker koagulering..
Varmeoverføring og lagring
Den binære blandingen av smeltede nitratsalter, inkludert kalsium med andre nitrater, brukes i stedet for termisk olje i solkraftverk for varmeoverføring og lagring.
Søknadsformer
-Kalsiumnitrat påføres blandet med jorda i en konsentrasjon på 1,59 kg per 30,48 mto, med tilstrekkelig vanning. Kalsiumnitrat oppløses i vann, slik at det absorberes av plantens røtter. I hydroponiske avlinger oppløses den i voksende vann.
-Kalsiumnitrat brukes også i form av en spray for å spraye bladene og blomstene, og er en effektiv behandling for å forhindre rotting av tomatblomsten, korkflekken og den bitre gropen av eplet..
-En mengde kalsiumnitrat tilsettes den betongdannende blandingen (sement, sand, steiner og vann), og effekten som tilsetningen har på betongens spesifikke egenskaper bestemmes; slik som å sette hastighet og styrke.
-Kalsiumnitrat tilsettes i en passende konsentrasjon for å redusere lukt fra kloakk eller avløpsvann, til et nivå som lukt er tålelig for mennesker.
Referanser
- Bonnie L. Grant. (2019). Kalsiumnitratgjødsel - Hva gjør kalsiumnitrat for planter. Gjenopprettet fra: gardeningknowhow.com
- Farquharson, B.F., Vroney, R.P., Beauchamp, E.G. og Vyn, T.J. (1990). Bruk av kalsiumnitrat for å redusere fytotoksinakkumulering under nedbrytning av korpsrester. Canadian Journal of Soil Science 70 (4): 723-726.
- Ogunbode, E. B. og Hassan, I.O. (2011). Effekt av tilsetning av kalsiumnitrat på selektive egenskaper av betong som inneholder vulkansk aske. Leonardo Electronic Journal of Practices Technologies 19: 29-38.
- Wikipedia. (2019). Kalsiumnitrat. Gjenopprettet fra: en.wikipedia.org
- Shiqi Dong og kol. (2018). Inhibering av stålkorrosjon av kalsiumnitrat i halogenidberiket kompletteringsvæske. npj Materialer Nedbrytningsvolum 2, Artikkelnummer: 32.
- Emaginationz Technologies. (2019). Spesifikasjoner for kalsiumnitrat. Gjenopprettet fra: direct2farmer.com
- PubChem. (2019). Kalsiumnitrat. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov



Ingen har kommentert denne artikkelen ennå.