
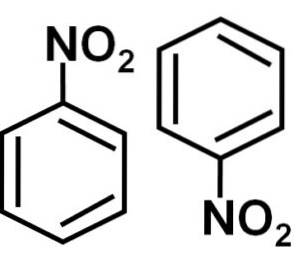
Nitrobenzen (C6H5NO2) struktur, egenskaper, bruksområder, risiko
De nitrobenzen er en aromatisk organisk forbindelse dannet av en benzenring C6H5- og en nitro-NO-gruppeto. Dens kjemiske formel er C6H5IKKEto. Det er en fargeløs eller blekgul oljeaktig væske, som lukter bitre mandler eller skokrem..
Nitrobenzen er en veldig nyttig forbindelse i den kjemiske industrien fordi det gjør det mulig å oppnå en serie kjemiske stoffer som har forskjellige bruksområder. Dette er fordi det kan bli utsatt for forskjellige typer reaksjoner.
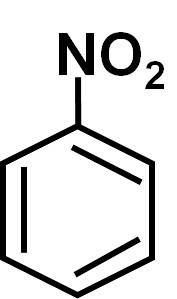
Viktige kjemiske reaksjoner inkluderer nitrering (som gjør at flere -NO-grupper kan tilsettesto til molekylet) og reduksjon (det motsatte av oksidasjon siden de to oksygenatomene i nitro-NO-gruppen er eliminertto og erstattes av hydrogener).
Med nitrobenzen kan for eksempel anilin og para-acetaminophenol fremstilles. Sistnevnte er det velkjente acetaminophen som er febernedsettende (medisin mot feber) og mildt smertestillende middel (medisin mot mindre smerte)..
Nitrobenzen bør håndteres med forsiktighet da det er irriterende og giftig, det kan forårsake en type anemi, blant flere symptomer, og det antas å forårsake kreft. Det er også skadelig for miljøet.
Artikkelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 eiendommer
- 3.1 Fysisk tilstand
- 3.2 Molekylvekt
- 3.3 Smeltepunkt
- 3.4 Kokepunkt
- 3.5 Flammepunkt
- 3.6 Selvantennelsestemperatur
- 3.7 Tetthet
- 3.8 Løselighet
- 3.9 Kjemiske egenskaper
- 3.10 Dimer formasjon
- 3.11 Andre egenskaper
- 4 Motta
- 5 bruksområder
- 5.1 Ved oppnåelse av anilin og paracetamol
- 5.2 Ved oppnåelse av andre kjemiske forbindelser
- 5.3 I forskjellige applikasjoner
- 6 Risiko
- 7 Behandlinger for eliminering fra miljøet
- 8 Referanser
Struktur
Nitrobenzen C6H5-IKKEto er et flatt molekyl dannet av en benzenring C6H5- som en nitro-NO-gruppe er knyttet tilto. Molekylet er flatt fordi det er en elektronisk interaksjon mellom nitro-NO-gruppento og benzenringen.
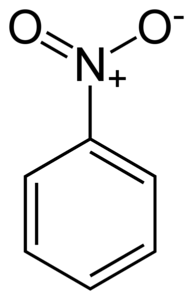
Nitro -NO-gruppento har en tendens til å tiltrekke seg elektroner fra benzenringen C6H5-.
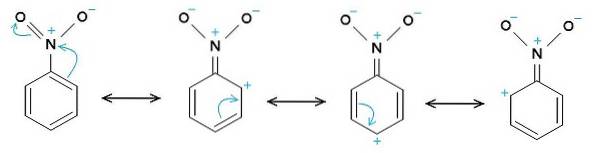
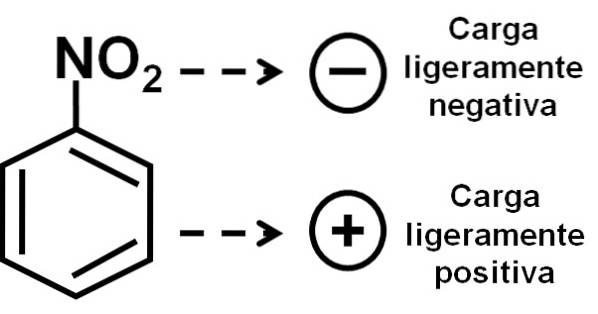
Derfor har molekylet en litt mer negativ side (hvor oksygene av -NOto) og en litt mer positiv side (benzenringen).
Nomenklatur
- Nitrobenzen.
- Nitrobenzin.
- Nitrobenzol.
- Myrban eller myrban olje eller essens (ubrukt begrep).
Eiendommer
Fysisk tilstand
Fargeløs til lysegul oljeaktig væske.
Molekylær vekt
123,11 g / mol.
Smeltepunkt
5,7 ºC.
Kokepunkt
211 ºC.
Flashpoint
88 ºC (lukket koppmetode).
Selvantennelsestemperatur
480 ° C.
Tetthet
1,2037 g / cm3 ved 20 ºC.
Løselighet
Litt løselig i vann: 0,19 g / 100 g vann ved 20 ° C. Fullt blandbar med alkohol, benzen og dietyleter.
Kjemiske egenskaper
Nitrobenzen er stabil opp til ca. 450 ° C temperatur hvor den begynner å spaltes og danner (i fravær av oksygen) NO, NOto, benzen, bifenyl, anilin, dibenzofuran og naftalen.
Viktige nitrobenzenreaksjoner inkluderer reduksjon, nitrering, halogenering og sulfonering..
Nitrering av nitrobenzen produserer først metanitrobenzen og med en lengre reaksjonstid oppnås 1,3,5-nitrobenzen.
Ved å reagere brom eller klor med nitrobenzen i nærvær av en passende katalysator, oppnås 3-brom-nitrobenzen (meta-bromnitrobenzen) eller 3-klor-nitrobenzen (metakloronitrobenzen)..
Et eksempel på reduksjon er at når man behandler med tinn (Sn) i saltsyre (HCl), oppnås meta-halogenonitrobenzenene meta-halogenanilinene.
Nitrobenzensulfonering utføres med røykende svovelsyre ved 70-80 ° C, og produktet er metanitrobenzensulfonsyre. Dette kan reduseres med jern og HCl for å gi metanilinsyre..
Dimer formasjon
I en løsning av benzen C6H6 nitrobenzen molekyler assosieres med hverandre for å danne dimerer eller par av molekyler. I disse parene er ett av molekylene i en omvendt posisjon i forhold til det andre..
Dannelsen av nitrobenzen-dimerer med molekyler en i en omvendt posisjon i forhold til den andre skyldes muligens at hver av dem har en litt mer positivt ladet side og en motsatt side med en litt mer negativ ladning..
I dimeren er siden med en litt mer positiv ladning av et av molekylene muligens lokalisert nær den litt negative ladningen til det andre molekylet, siden de motsatte ladningene tiltrekker hverandre, og dette er tilfellet med de to andre sidene..
Andre egenskaper
Har en lukt som mandler eller skokrem. Når temperaturen senkes, stivner den i form av grønn-gule krystaller.
Å skaffe
Oppnådd ved behandling av benzen C6H6 med en blanding av salpetersyre HNO3 og svovelsyre HtoSW4. Prosessen kalles nitrering og involverer dannelsen av nitroniumionen NOto+ takket være tilstedeværelsen av svovelsyre HtoSW4.
- NO-dannelse av nitroniumionto+:
HNO3 + 2 timertoSW4 ⇔ H3ELLER+ + 2 HSO4- + IKKEto+ (nitroniumion)
- Nitroniumion angriper benzen:
C6H6 + IKKEto+ → C6H6IKKEto+
- Nitrobenzen dannes:
C6H6IKKEto+ + HSO4- → C6H5IKKEto + HtoSW4
Oppsummert:
C6H6 + HNO3 → C6H5IKKEto + HtoELLER
Nitreringsreaksjonen av benzen er veldig eksoterm, det vil si at det genereres mye varme, så det er veldig farlig.
applikasjoner
Ved å oppnå anilin og paracetamol
Nitrobenzen brukes hovedsakelig til å syntetisere anilin C6H5NHto, som er en forbindelse mye brukt til fremstilling av plantevernmidler, tannkjøtt, fargestoffer, eksplosiver og medisiner.
Å skaffe anilin skjer ved å redusere nitrobenzen i et surt medium i nærvær av jern eller tinn, som utføres i henhold til følgende trinn:
Nitrobensen → Nitrosobensen → Fenylhydroksylamin → Anilin
C6H5IKKEto → C6H5NO → C6H5NHOH → C6H5NHto

Avhengig av forholdene kan prosessen stoppes i et av de mellomliggende trinnene, for eksempel fenylhydroksylamin. Med utgangspunkt i fenylhydroksylamin i et sterkt surt medium kan para-aminofenol fremstilles:
Fenylhydroksylamin → s-Aminofenol
C6H5NHOH → HOC6H4NHto
Sistnevnte blir behandlet med eddiksyreanhydrid for å oppnå paracetamol (acetaminophen), et kjent febernedsettende og mildt smertestillende middel, det vil si et legemiddel for å behandle feber og smerte..
En annen måte å oppnå anilin på er å redusere nitrobenzen med karbonmonoksid (CO) i et vandig medium i nærvær av svært små partikler (nanopartikler) av palladium (Pd) som en katalysator..
C6H5-IKKEto + 3 CO + HtoO → C6H5-NHto + 3 COto
Ved å oppnå andre kjemiske forbindelser
Nitrobenzen er utgangspunktet for å oppnå et stort utvalg av forbindelser som brukes som fargestoffer, plantevernmidler, medisiner og kosmetikk.

For eksempel gjør det det mulig å oppnå 1,3-dinitrobenzen, som ved klorering (tilsetning av klor) og reduksjon (eliminering av oksygenatomer) genererer 3-kloranilin. Dette brukes som et mellomprodukt for plantevernmidler, fargestoffer og medisiner.
Nitrobenzen ble brukt til å fremstille benzidin som er et fargestoff. I tillegg brukes nitrobenzen til å fremstille kinolin, azobenzen, metanilsyre, dinitrobenzen, isocyanater eller pyroksylin blant mange andre forbindelser..
I forskjellige applikasjoner
Nitrobenzen brukes eller har blitt brukt som:
- Ekstraksjonsløsningsmiddel for rensing av smøreoljer som brukes i maskiner
- Løsemiddel for celluloseetere
- Metall polering blanding ingrediens
- I såper
- I blandinger av polering av sko
- Spraymalingskonserveringsmiddel
- Komponent av gulvpoleringblandinger
- Mandel essens erstatning
- I parfymeindustrien
- I produksjonen av syntetisk gummi
- Løsemiddel i forskjellige prosesser

Risiko
Nitrobenzen er giftig ved innånding, svelging og absorpsjon gjennom huden..
Irriterer huden, øynene og luftveiene. Det kan forårsake en type anemi kalt methemoglobinemia, som innebærer en reduksjon i evnen til røde blodlegemer til å frigjøre oksygen i vevet og fører til utmattelse..
I tillegg forårsaker nitrobenzen dyspné, svimmelhet, nedsatt syn, kortpustethet, kollaps og død. Det skader også leveren, milten, nyrene og sentralnervesystemet.
Det anslås at det kan være et mutagen og muligens årsak til kreft hos mennesker, siden det har forårsaket det hos dyr.
I tillegg skal nitrobenzen ikke kastes i miljøet. Dens toksisitet mot dyr, planter og mikroorganismer gjør det veldig skadelig for økosystemer.
Toksisitet mot mikroorganismer reduserer deres biologiske nedbrytbarhet.
Behandlinger for eliminering fra miljøet
Forurensning av miljøet med nitrobenzen kan skje gjennom avfall fra de forskjellige industriene som bruker det, for eksempel fargestoff- eller sprengstoffindustrien..
Nitrobenzen er et meget giftig forurensende stoff og vanskelig å spaltes under naturlige forhold, og kan derfor forårsake alvorlig forurensning av drikkevann og vanningsanlegg..
På grunn av sin høye stabilitet og toksisitet overfor mikroorganismer, blir den ofte valgt som modell i avløpsbehandlingsstudier..
Det undersøkes forskjellige måter å fjerne nitrobenzen fra forurenset vann på. En av dem er gjennom fotokatalytisk nedbrytning, det vil si å bruke sollys som en akselerator for nedbrytningsreaksjonen i nærvær av titandioksid TiOto.

Mikroelektrolysemetoder med en jern (Fe) og kobber (Cu) katalysator i keramikk har også blitt testet. Mikroelektrolyse gjør at nitrobenzen kan brytes ned av en elektrisk strøm.
Referanser
- OSS. National Library of Medicine. (2019). Nitrobenzen. Gjenopprettet fra pubchem.ncbi.nlm.nih.gov.
- Morrison, R.T. og Boyd, R.N. (2002). Organisk kjemi. 6. utgave. Prentice-Hall.
- Moldoveanu, S.C. (2019). Pyrolyse av andre nitrogenholdige forbindelser. In Pyrolysis of Organic Molecules (Andre utgave). Gjenopprettet fra sciencedirect.com.
- Smith, P.W.G. et al. (1969). Aromatiske nitrering-nitroforbindelser. Elektrofile erstatninger. I aromatisk kjemi. Gjenopprettet fra sciencedirect.com.
- Windholz, M. et al. (redaktører) (1983). Merck-indeksen. En leksikon med kjemikalier, medisiner og biologiske stoffer. Tiende utgave. Merck & CO., Inc..
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Femte utgave. Volum A22. VCH Verlagsgesellschaft mbH.
- Whang, T.-J. et al. (2012). UV-bestrålt fotokatalytisk nedbrytning av nitrobenzen ved Titania Binding på kvartsrør. International Journal of Photoenergy, bind 2012, artikkel-ID 681941. Gjenopprettet fra hindawi.com.
- Shikata, T. et al. (2014). Nitrobenzen anti-parallell dimerdannelse i ikke-polære løsningsmidler. AIP Advances 4, 067130 (2014). Gjenopprettet fra doaj.org.
- Krogul-Sobczak, A. et al. (2019). Reduksjon av nitrobenzen til anilin med CO / HtoO i nærvær av Palladium-nanopartikler. Katalysatorer 2019, 9, 404. Gjenopprettet fra mdpi.com.
- Yang, B. et al. (2019). Pilot-skala produksjon, egenskaper og anvendelse av Fe / Cu katalytisk-keramisk fyllstoff for nitrobenzenforbindelser avløpsrensing. Katalysatorer 2019, 9, 11. Gjenopprettet fra mdpi.com.



Ingen har kommentert denne artikkelen ennå.