
Bariumperoksyd (BaO2) struktur, egenskaper og bruksområder

De bariumperoksid er en ionisk og uorganisk forbindelse med den kjemiske formelen BaOto. Å være en ionisk forbindelse, består den av Ba-ionerto+ megtoto-; sistnevnte er det som er kjent som peroksidanion, og på grunn av det BaOto får navnet sitt. Dette er tilfelle, BaOto er et uorganisk peroksid.
Ladningene av ionene avslører hvordan denne forbindelsen dannes av elementene. Gruppe 2 bariummetall gir to elektroner til oksygenmolekylet, Oto, hvis atomer ikke brukes til å redusere seg selv til oksidanioner, ORto-, men å bli holdt sammen av en enkel lenke, [O-O]to-.

Bariumperoksid er et granulært fast stoff ved romtemperatur, hvitt i fargen med svake gråtoner (øvre bilde). Som nesten alle peroksider, må det håndteres og lagres med forsiktighet, da det kan akselerere oksidasjonen av visse stoffer.
Av alle peroksidene dannet av gruppe 2-metaller (Mr. Becambara), BaOto den er termodynamisk den mest stabile mot dens termiske nedbrytning. Ved oppvarming frigjør den oksygen, og bariumoksid, BaO, produseres. BaO kan reagere med oksygen i miljøet, ved høyt trykk, for å danne BaO igjento.
Artikkelindeks
- 1 Struktur
- 1.1 Krystallgitterenergi
- 1.2 Hydrater
- 2 Forberedelse eller syntese
- 3 eiendommer
- 3.1 Fysisk utseende
- 3.2 Molekylær masse
- 3.3 Tetthet
- 3.4 Smeltepunkt
- 3.5 Kokepunkt
- 3.6 Løselighet i vann
- 3.7 Termisk spaltning
- 4 Nomenklatur
- 5 bruksområder
- 5.1 Oksygenprodusent
- 5.2 Produsent av hydrogenperoksid
- 6 Referanser
Struktur
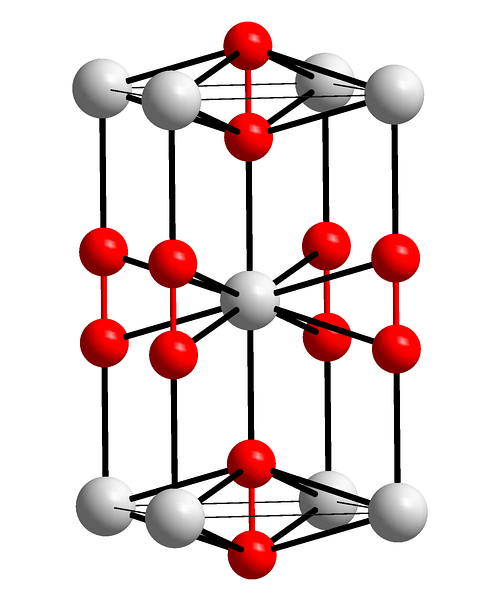
Det øvre bildet viser den tetragonale enhetscellen av bariumperoksid. Inne i det kan man se kationene Bato+ (hvite kuler), og anionene Ototo- (røde kuler). Merk at de røde kulene er forbundet med en enkeltbinding, så de representerer lineær geometri [O-O]to-.
Fra denne enhetscellen kan BaO-krystaller byggesto. Hvis observert, anion Ototo- det er sett å være omgitt av seks Bato+, skaffe en oktaeder som har hvite hjørner.
På den annen side, enda tydeligere, hver Bato+ er omgitt av ti Ototo- (hvit kule i midten). All krystall består av denne konstante rekkefølgen på kort og lang rekkevidde.
Krystallgitterenergi
Hvis de røde hvite kulene også observeres, vil det bemerkes at de ikke skiller seg for mye i størrelser eller ioniske radier. Dette er fordi Ba-kasjonento+ er veldig klumpete, og dets interaksjoner med anionen Ototo- stabilisere krystallens gitterenergi i bedre grad sammenlignet med hvordan for eksempel kationer ville gjortto+ og Mgto+.
Dette forklarer også hvorfor BaO er den mest ustabile av de jordalkaliske oksidene: Ba-ioner.to+ megto- varierer betydelig i størrelse og destabiliserer krystallene deres.
Ettersom det er mer ustabilt, jo lavere er trenden med BaOto spaltes for å danne BaO; i motsetning til peroksider SrOto, CaOto og MgOto, hvis oksider er mer stabile.
Hydrater
BaOto kan finnes i form av hydrater, hvorav BaOto∙ 8HtoEller det er det mest stabile av alle; og faktisk er dette den som markedsføres i stedet for det vannfrie bariumperoksidet. For å oppnå den vannfrie må BaO tørkes ved 350 ° Cto∙ 8HtoEller for å fjerne vannet.
Krystallstrukturen er også tetragonal, men med åtte molekyler av HtoO samhandler med Ototo- gjennom hydrogenbindinger, og med Bato+ av dipol-ion-interaksjoner.
Andre hydrater, hvis strukturer det ikke er mye informasjon i denne forbindelse, er: BaOto∙ 10HtoO, BaOto∙ 7HtoO og BaOto∙ HtoELLER.
Forberedelse eller syntese
Den direkte tilberedningen av bariumperoksid består av oksidasjon av oksydet. Dette kan brukes fra mineral baritt, eller fra bariumnitratsalt, Ba (NO3)to; begge oppvarmes i en luft- eller oksygenberiket atmosfære.
En annen metode består i å reagere Ba (NO3)to med natriumperoksid:
Bad3)to + NatoELLERto + xHtoO => BaOto∙ xHtoO + 2NaNO3
Deretter hydreres BaOto∙ xHtoEller den utsettes for oppvarming, filtreres og tørkes med vakuum.
Eiendommer
Fysisk utseende
Det er et hvitt fast stoff som kan bli gråaktig hvis det har urenheter (enten BaO, Ba (OH)to, eller andre kjemiske arter). Hvis den varmes opp til veldig høy temperatur, vil den avgi grønnaktig flamme på grunn av de elektroniske overgangene til Ba-kationene.to+.
Molekylær masse
169,33 g / mol.
Tetthet
5,68 g / ml.
Smeltepunkt
450 ° C.
Kokepunkt
800 ° C Denne verdien er i samsvar med hva som kan forventes av en ionisk forbindelse; og enda mer, av det mest stabile jordalkaliske peroksydet. Imidlertid koker ikke BaO egentligto, snarere frigjøres gassformet oksygen som et resultat av dets termiske nedbrytning.
Vannløselighet
Uoppløselig. Imidlertid kan den sakte gjennomgå hydrolyse for å produsere hydrogenperoksid, HtoELLERto; og dessuten øker dets løselighet i vandig medium hvis en fortynnet syre tilsettes.
Termisk nedbrytning
Følgende kjemiske ligning viser den termiske nedbrytningsreaksjonen som BaO gjennomgårto:
2BaOto <=> 2BaO + Oto
Reaksjonen er enveis hvis temperaturen er over 800 ° C. Hvis trykket øyeblikkelig økes og temperaturen synker, vil all BaO bli transformert tilbake til BaOto.
Nomenklatur
En annen måte å gi BaO navnetto det er bariumperoksid, i henhold til den tradisjonelle nomenklaturen; siden barium bare kan ha valensen +2 i forbindelsene.
Feil, den systematiske nomenklaturen brukes til å referere til den som bariumdioksid (binoxide), med tanke på at det er et oksid og ikke et peroksid.
applikasjoner
Oksygenprodusent
Ved bruk av mineralbaritt (BaO) varmes det opp med luftstrømmer for å eliminere oksygeninnholdet, ved en temperatur på rundt 700 ° C..
Hvis det resulterende peroksidet varmes forsiktig opp under vakuum, regenereres oksygenet raskere, og baritten kan brukes på ubestemt tid for å lagre og produsere oksygen..
Denne prosessen ble kommersielt utviklet av L. D. Brin, nå foreldet.
Hydrogenperoksidprodusent
Bariumperoksid reagerer med svovelsyre for å produsere hydrogenperoksid:
Stråleto + HtoSW4 => HtoELLERto + Baso4
Det er derfor en kilde til HtoELLERto, manipulert spesielt med hydrat BaOto∙ 8HtoELLER.
I henhold til disse to bruksområdene, BaOto tillater utvikling av Oto og HtoELLERto, både oksidasjonsmidler, i organisk syntese og i blekeprosesser i tekstil- og fargestoffindustrien. Det er også et godt desinfeksjonsmiddel..
Videre fra BaOto andre peroksider kan syntetiseres, slik som natrium, NatoELLERto, og andre bariumsalter.
Referanser
- S.C. Abrahams, J Kalnajs. (1954). Krystallstrukturen til bariumperoksid. Laboratory for Insulation Research, Massachusetts Institute of Technology, Cambridge, Massachusetts, USA.
- Wikipedia. (2018). Bariumperoksid. Gjenopprettet fra: en.wikipedia.org
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Atomistry. (2012). Bariumperoksid. Gjenopprettet fra: barium.atomistry.com
- Khokhar et al. (2011). Studie av forberedelse av laboratorieskala og utvikling av en prosess for bariumperoksid. Gjenopprettet fra: academia.edu
- PubChem. (2019). Bariumperoksid. Gjenopprettet fra: pubchem.ncbi.nlm.nih.gov
- PrebChem. (2016). Fremstilling av bariumperoksid. Gjenopprettet fra: prepchem.com


Ingen har kommentert denne artikkelen ennå.