
Propylen kjemisk struktur, egenskaper og bruksområder

De propylen eller propen ved omgivelsestemperatur og atmosfæretrykk er i gassform og er, som andre alkener, fargeløs. Den har en lukt som olje, men mindre intens. Det presenterer et dipolmoment siden, selv om det mangler en sterk polarbinding, er molekylet dets asymmetrisk.
Likeledes er propylen en strukturell isomer av cyklopropan (de har samme kjemiske formel C3H6). Det forekommer i naturen som en konsekvens av prosessene med vegetasjon og gjæring. Det produseres kunstig under prosessering av fossile brensler som olje, naturgass og, i mindre grad, karbon.

Tilsvarende er etylen og propylen produkter av petroleumsraffinering i en prosess med å dele store hydrokarbonmolekyler for å generere små hydrokarboner i stor etterspørsel..
Propylen kan også fås ved hjelp av forskjellige metoder:
- Ved å reversere reaksjon av etylen og buten, hvor dobbeltbindinger brytes og omformuleres for å gi propylen.
- Gjennom en prosess med dehydrogenering (tap av hydrogen) av propan.
- Som en del av et program for å produsere olefiner fra metanol (MTO), ble propylen produsert fra metanol. Dette ble ført gjennom zeolittkatalysatoren, som fremmer dehydrering og fører til dannelse av etylen og propylen..
3CH3OH (metanol) => CH3CH = CHto (propylen) + 3HtoO (vann)
Artikkelindeks
- 1 Kjemisk struktur
- 2 eiendommer
- 2.1 Molekylvekt
- 2.2 Kokepunkt
- 2.3 Smeltepunkt
- 2.4 Flammepunkt
- 2.5 Løselighet
- 2.6 Løselighet uttrykt som masse
- 2.7 Tetthet
- 2.8 Damptetthet
- 2.9 Damptrykk
- 2.10 Selvantennelse
- 2.11 Viskositet
- 2.12 Forbrenningsvarme
- 2.13 Fordampningsvarme
- 2.14 Overflatespenning
- 2.15 Polymerisering
- 2.16 Frysepunkt
- 2.17 Luktterskel
- 3 bruksområder
- 3.1 Polypropylen
- 3.2 Akrylnitril
- 3.3 Propylenoksid
- 3.4 For syntese av alkoholer og annen bruk
- 4 Referanser
Kjemisk struktur
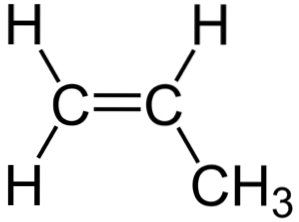
På det øvre bildet kan du se den kjemiske strukturen til propylen, der dens asymmetri skiller seg ut (høyre side er forskjellig fra venstre). Dens karbonskjelett, unntatt H-atomene, kan sees på som en boomerang.
Denne boomerangen har en umettethet eller dobbeltbinding på en av sidene (C1) og er dermed flat på grunn av sp-hybridiseringto av karbonatomer.
Den andre siden er imidlertid okkupert av metylgruppen (-CH3), hvis hybridisering er sp3 og har en tetrahedral geometri. Så sett forfra er boomerangen flat med H-atomene som stikker ut fra den ved omtrent 109,5 °.
I gassfasen interagerer molekylet svakt med andre ved dispersjonskrefter. Likeledes forhindres interaksjonen mellom dobbeltbindingen (π-π) av to propylenmolekyler av metylgruppen.
Dette resulterer i en reduksjon i intermolekylære krefter, noe som gjenspeiles i dets fysiske egenskaper. Bare ved veldig lave temperaturer kan propylen vedta en solid struktur, der boomerangen forblir gruppert med sine svake interaksjoner.
Eiendommer
Det er en fargeløs gass med en aromatisk lukt. Den transporteres i form av flytende gass, og når den rømmer fra beholderne som inneholder den, gjør den det i form av en gass eller væske. Ved lave konsentrasjoner danner det en eksplosiv og brennbar blanding med luft, og tettheten av propylen er større enn luftens..
Molekylær vekt
42,081 g / mol
Kokepunkt
53,9 ºF ved 760 mmHg
48 ºC til 760 mmHg
Smeltepunkt
301,4 ºF
185 ºC
Flammepunkt
162ºF
Løselighet
44,6 ml / 100 ml i vann.
1250 ml / 100 ml i etanol.
524,5 ml / 100 ml eddiksyre.
Løselighet uttrykt som masse
200 mg / l 25 ºC
Tetthet
0,609 mg / ml ved -52,6 ° F
0,5139 ved 20 ° C
Damptetthet
1,46 ved 32 ° F (i forhold til luft tatt som referanse).
1,49 (luft = 1).
1,91 kg / m3 ved 273,15 ºK
Damptrykk
1 mmHg ved -205,4 ° F
760 mmHg ved -53,9 ° F
8,69 × 103 mmHg ved 25 ºC (ekstrapolert verdi).
1.158 kPa ved 25 ºC
15,4 atm ved 37 ºC
Selvantennelse
851ºF
455 ºC
Viskositet
83,4 mikropoise ved 16,7 ºC.
Forbrenningsvarme
16.692 BTU / lb
10 940 cal / g
Fordampningsvarme
104,62 cal / g (ved kokepunkt)
Overflatespenning
16,7 dyn / cm ved 90 ° C
Polymerisering
Polymeriserer ved høye temperaturer og høyt trykk i nærvær av katalysatorer.
Frysepunktet
185,25 ° C.
Luktterskel
10-50 mg / m3 (gjenkjenning)
100 mg / m3 (Anerkjennelse)
applikasjoner
Den brukes i petrokjemisk industri som drivstoff og alkyleringsmiddel. I den kjemiske industrien brukes det som råmateriale for produksjon og syntese av mange derivater.
Det er hovedsakelig nyttig i produksjonen av polypropylen, akrylnitril (ACN), propylenoksid (PO), alkoholer, kumen og akrylsyre.
Polypropylen
Polypropylen er et av de viktigste plastmaterialene som brukes i elektronikk og elektrisk tilbehør, husholdningsartikler, flaskehetter og kofferter..
Det laminerte materialet brukes i emballasje av søtsaker, etiketter, CD-plater, etc., mens fibrene brukes til å lage mapper og klær..
Akrylnitril
Elastomere polymerer og fibre erholdes fra akrylnitril. Disse fibrene brukes til produksjon av forskjellige former for klær, som gensere, sokker og sportsklær. De brukes også i hjemmemøbler, mapper, polstring, puter og tepper..
Propylens oksid
Propylenoksyd deltar som en komponent i syntesen av polyuretan. Dette brukes til fremstilling av fleksibelt skum og stivt skum. Fleksibelt skum brukes som fyllstoff i hjemmemøbler og i bilindustrien.
På den annen side brukes stivt skum hovedsakelig som bygningsisolasjonsmateriale..
Også propylenoksyd brukes i produksjonen av propylenglykol. Denne forbindelsen brukes til fremstilling av umettede polyesterharpikser og som frostvæske..
I tillegg brukes propylenoksyd i produksjonen av propylenglykoleter. Denne eteren kan brukes til fremstilling av maling, klær, blekk, harpiks og rengjøringsmidler.
For alkoholsyntese og annen bruk
Propylen tillater oppnåelse av noen alkoholer, blant dem isopropanol, brukt som løsemiddel i kosmetikk og personlig pleieprodukter. I tillegg oppfyller den funksjonen til et antiseptisk middel.
- Isopropanol er involvert i fremstilling av maling, harpiks, blekk og klebebånd. Det brukes også i farmasøytisk industri.
- Okso-alkohol2-etylheksanol brukes til produksjon av ftalat, myknere, klebematerialer og maling.
- Butanol brukes til fremstilling av maling, belegg, harpiks, fargestoffer, legemidler og polymerer.
På den annen side produseres kumen fra kombinasjonen av propylen og benzen. Kumen er hovedforbindelsen ved fremstilling av fenol og aceton, brukt i en rekke produkter, slik som polykarbonater, fenolharpikser, epoksyharpikser og metylmetakrylat..
Til slutt brukes akrylsyre - et annet produkt avledet fra propylen - til fremstilling av akrylestere og harpikser for maling, belegg og klebemiddelapplikasjoner..
Referanser
- Michal Osmenda. (26. desember 2007). Tenn ilden min. [Figur]. Hentet 23. mai 2018 fra: commons.wikimedia.org
- Linde-gruppen. (2018). Propylen. Hentet 23. mai 2018 fra: linde-gas.com
- Wikipedia. (2018). Propene. Hentet 23. mai 2018 fra: en.wikipedia.org
- PubChem. (2018). Propylen. Hentet 27. mai 2018 fra: pubchem.ncbi.nlm.nih.gov
- Vesovic Velisa. (7. februar 2011). Propylen. Hentet 27. mai 2018 fra: thermopedia.com
- Jeffrey S. Plotkin. (2016, 8. august). Propylen-vanskeligheten. Hentet 27. mai 2018 fra: acs.org
- ICIS. (6. november 2017). Propylenbruk og markedsdata. Hentet 27. mai 2018 fra: icis.com


Ingen har kommentert denne artikkelen ennå.