
Hva er en koordinat kovalent binding? (med eksempler)

EN koordinere kovalent binding eller koordineringskobling eren type binding der et av de tilknyttede atomene forsyner alle delte elektroner.
I en enkel kovalent binding tilfører hvert atom ett elektron til bindingen. På den annen side, i en koordineringsbinding, kalles atomene som donerer elektronet for å danne en binding, donoratomet, mens atomet som aksepterer paret elektroner som blir med, kalles akseptatom (Clark, 2012)..
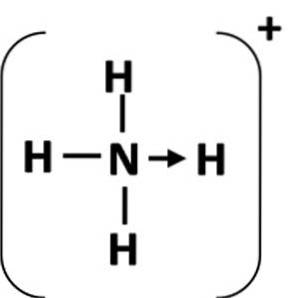
En koordineringsbinding er representert av en pil som starter fra donoratomene og slutter ved akseptoratom (figur 1). I noen tilfeller kan giveren være et molekyl.
I dette tilfellet kan et atom i molekylet donere elektronparet, som vil være Lewis-basen mens molekylet med akseptorkapasitet vil være Lewis-syren (Coordinate Covalent Bond, S.F.).
En koordineringsbinding har egenskaper som ligner på en enkel kovalent binding. Forbindelser som har denne typen binding har generelt et lavt smelte- og kokepunkt, med en ikke-eksisterende coulombisk interaksjon mellom atomene (i motsetning til ionebindingen) og forbindelsene er veldig oppløselige i vann (Atkins, 2017).
Noen eksempler på koordinere kovalente bindinger
Det vanligste eksemplet på en koordineringsbinding er ammoniumionet, som dannes ved kombinasjonen av et ammoniakkmolekyl og en proton fra en syre.
I ammoniakk har nitrogenatomet et par elektroner etter fullføring av oktetten. Doner dette ensomme paret til hydrogenionet, og dermed blir nitrogenatomet en donor. Hydrogenatomet blir akseptoren (Schiller, S.F.).
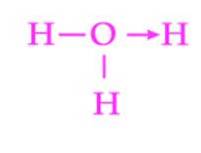
Et annet vanlig eksempel på en dativbinding er dannelsen av hydroniumionet. Som med ammoniumionet, fungerer det frie elektronparet til vannmolekylet som en donor til protonet som er akseptoren (figur 2)..
Imidlertid bør det bemerkes at når koordineringsbåndet er etablert, er alle hydrogener festet til oksygen nøyaktig ekvivalente. Når et hydrogenion brytes ned igjen, er det ingen forskjell mellom hvilke av hydrogenene som frigjøres.
Et utmerket eksempel på en Lewis-syre-base-reaksjon, som illustrerer dannelsen av en koordinert kovalent binding, er dannelsesreaksjonen av bortrifluoridadduktet med ammoniakk..
Bortrifluorid er en forbindelse som ikke har en edelgassstruktur rundt boratomet. Bor har bare 3 par elektroner i valensskallet, så BF3 sies å være elektronmangel.
Det ikke delte elektronparet ammoniakknitrogen kan brukes til å overvinne den mangelen, og det dannes en forbindelse som involverer en koordineringsbinding..
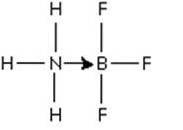
Det paret elektroner fra nitrogen blir donert til borets tomme p-bane. Her er ammoniakk Lewis-basen og BF3 er Lewis-syren.
Koordineringskjemi
Det er en gren av uorganisk kjemi dedikert utelukkende til studiet av forbindelser som danner overgangsmetaller. Disse metallene forbinder andre atomer eller molekyler gjennom koordineringsbindinger for å danne komplekse molekyler..
Disse molekylene er kjent som koordineringsforbindelser, og vitenskapen som studerer dem kalles koordineringskjemi..
I dette tilfellet er stoffet bundet til metallet, som vil være elektrondonoren, kjent som en ligand, og koordineringsforbindelser er ofte kjent som komplekser..
Koordineringsforbindelser inkluderer stoffer som vitamin B12, hemoglobin og klorofyll, fargestoffer og pigmenter, og katalysatorer brukt til fremstilling av organiske stoffer (Jack Halpern, 2014).
Et eksempel på et komplekst ion ville være koboltkomplekset [Co (NHtoCHtoCHtoNHto) 2ClNH3]to+ hva ville være dikloraminaminetylendiaminkobolt (IV).
Koordineringskjemi vokste ut av arbeidet til Alfred Werner, en sveitsisk kjemiker som undersøkte forskjellige forbindelser av kobolt (III) klorid og ammoniakk. Etter tilsetning av saltsyre fant Werner at ammoniakken ikke kunne fjernes helt. Han foreslo da at ammoniakk skulle være nærmere bundet til det sentrale koboltionet.
Imidlertid, når vandig sølvnitrat ble tilsatt, var et av produktene som ble dannet fast sølvklorid. Mengden dannet sølvklorid var relatert til antall ammoniakkmolekyler bundet til kobolt (III) klorid..
For eksempel når sølvnitrat ble tilsatt til CoCl3 6NH3, de tre kloridene ble sølvklorid.
Når sølvnitrat ble tilsatt til CoCl3 5NH3, bare 2 av de 3 kloridene dannet sølvklorid. Da CoCl ble behandlet3.4NH3 med sølvnitrat, utfelt ett av de tre kloridene som sølvklorid.
De resulterende observasjonene foreslo dannelsen av komplekse eller koordinerende forbindelser. I den interne koordinasjonssfæren, som også i noen tekster er referert til som den første sfæren, er ligandene direkte festet til det sentrale metallet.
I den ytre koordinasjonssfæren, noen ganger kalt den andre sfæren, er andre ioner festet til det komplekse ionet. Werner ble tildelt Nobelprisen i 1913 for sin teori om koordinering (Introduction to Coordination Chemistry, 2017).
Denne koordinasjonsteorien gjør at overgangsmetaller har to typer valens: den første valensen, bestemt av oksidasjonsnummeret til metallet, og den andre valensen som kalles koordinasjonsnummeret..
Oksidasjonsnummeret forteller hvor mange kovalente bindinger som kan dannes i metallet (eksempel jern (II) produserer FeO) og koordinasjonstallet forteller hvor mange koordineringsbindinger som kan dannes i komplekset (eksempel jern med koordinasjonsnummer 4 produserer [FeCl4]- og [FeCl4]to-) (Koordineringsforbindelser, 2017).
Når det gjelder kobolt, har den et koordinasjonsnummer 6. Derfor ble det alltid oppnådd mengden sølvklorid som etterlot en heksakoordinert kobolt i Werner-eksperimenter når man tilsatte sølvnitrat..
Koordineringsbindingene til denne typen forbindelser har karakteristikken av å være farget.
Faktisk er de ansvarlige for den typiske fargen forbundet med et metall (rødt jern, blå kobolt, etc.) og er viktige for atomabsorpsjon og spektrofotometriske tester (Skodje, S.F.).
Referanser
- Atkins, P. W. (2017, 23. januar). Kjemisk binding. Gjenopprettet fra britannica.com.
- Clark, J. (2012, september). CO-ORDINATE (DATIV COVALENT) BONDING. Gjenopprettet fra chemguide.co.uk.
- Koordinere kovalent obligasjon. (S.F.). Gjenopprettet fra chemistry.tutorvista.
- Koordineringsforbindelser. (2017, 20. april). Gjenopprettet fra chem.libretexts.org.
- Introduksjon til koordineringskjemi. (2017, 20. april). Gjenopprettet fra chem.libretexts.org.
- Jack Halpern, G. B. (2014, 6. januar). Koordineringsmasse. Gjenopprettet fra britannica.com.
- Schiller, M. (S.F.). Koordinere kovalent binding. Gjenopprettet fra easychem.com.
- Skodje, K. (S.F.). Koordinere kovalent obligasjon: definisjon og eksempler. Gjenopprettet fra study.com.



Ingen har kommentert denne artikkelen ennå.