
Hva er vandige løsninger? (Med eksempler)
De vandige løsninger er de løsningene som bruker vann til å spalte et stoff. For eksempel gjørme eller sukkervann. Når en kjemisk art er oppløst i vann, betegnes dette ved å skrive (aq) etter det kjemiske navnet.
Hydrofile (vannelskende) stoffer og mange ioniske forbindelser oppløses eller dissosieres i vann. For eksempel, når bordsalt eller natriumklorid oppløses i vann, dissosieres det i ionene for å danne Na + (aq) og Cl- (aq).

Hydrofobe (vannfryktige) stoffer oppløses vanligvis ikke i vann eller danner vandige løsninger. Blanding av olje og vann fører for eksempel ikke til oppløsning eller dissosiasjon.
Mange organiske forbindelser er hydrofobe. Ikke-elektrolytter kan oppløses i vann, men de dissosieres ikke i ioner og opprettholder sin integritet som molekyler. Eksempler på ikke-elektrolytter inkluderer sukker, glyserol, urea og metylsulfonylmetan (MSM).
Egenskaper av vandige løsninger
Vandige løsninger leder ofte strøm. Løsninger som inneholder sterke elektrolytter har en tendens til å være gode elektriske ledere (f.eks. Sjøvann), mens løsninger som inneholder svake elektrolytter har en tendens til å være dårlige ledere (f.eks. Vann fra springen).
Årsaken er at sterke elektrolytter dissosierer seg fullstendig i ioner i vann, mens svake elektrolytter dissosierer seg ufullstendig..
Når kjemiske reaksjoner mellom arter forekommer i en vandig løsning, er reaksjonene vanligvis dobbeltforskyvningsreaksjoner (også kalt metatese eller dobbel substitusjon)..
I denne typen reaksjon tar kationen i det ene reagenset stedet for kationen i det andre reagenset, og danner typisk en ionebinding. En annen måte å tenke på det er at reaktive ioner "bytter partner".
Reaksjoner i vandig oppløsning kan produsere produkter som er oppløselige i vann eller kan produsere et bunnfall..
Et bunnfall er en forbindelse med lav løselighet som ofte faller ut av løsningen som et fast stoff..
Begrepene syre, base og pH gjelder bare for vandige oppløsninger. For eksempel kan du måle pH i sitronsaft eller eddik (to vandige oppløsninger) og de er svake syrer, men du kan ikke få noen meningsfull informasjon fra testen av vegetabilsk olje med pH-papir..
Hvorfor oppløses noen faste stoffer i vann?
Sukkeret vi bruker for å søte kaffe eller te er et molekylært fast stoff, der individuelle molekyler holdes sammen av relativt svake intermolekylære krefter..
Når sukker oppløses i vann, brytes de svake bindingene mellom individuelle sukrosemolekyler, og disse C12H22O11-molekylene frigjøres i oppløsning..
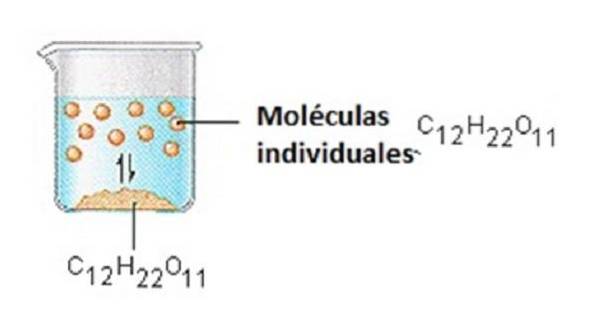
Det tar energi å bryte bindingene mellom C12H22O11-molekylene i sukrose. Det tar også energi å bryte hydrogenbindinger i vann som må brytes for å sette inn et av disse sukrosemolekylene i løsningen..
Sukker løses opp i vann fordi energi frigjøres når litt polære sukrosemolekyler danner intermolekylære bindinger med polære vannmolekyler..
De svake bindinger som dannes mellom løsemidlet og løsningsmidlet kompenserer for den energien som kreves for å endre strukturen til både den rene løsemidlet og løsningsmidlet..
Når det gjelder sukker og vann, fungerer denne prosessen så bra at opptil 1800 gram sukrose kan oppløses i en liter vann..
Ioniske faste stoffer (eller salter) inneholder positive og negative ioner, som holdes sammen takket være den store tiltrekningskraften mellom partikler med motsatte ladninger.
Når en av disse faste stoffene oppløses i vann, frigjøres ionene som utgjør det faste stoffet i oppløsning, hvor de assosieres med de polære løsemiddelmolekylene..
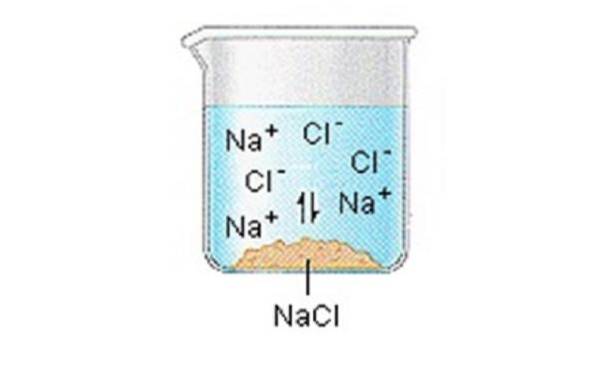
NaCl (s) ”Na + (aq) + Cl- (aq)
Vi kan generelt anta at salter dissosieres i ionene når de er oppløst i vann..
Joniske forbindelser oppløses i vann hvis energien som frigjøres når ionene samhandler med vannmolekylene oppveier energien som kreves for å bryte ionebindinger i det faste stoffet og energien som kreves for å skille vannmolekylene slik at ionene kan settes inn i løsningen.
Løselighetsregler
Avhengig av løseligheten til en løsemiddel, er det tre mulige utfall:
1) Hvis løsningen har mindre løsemiddel enn den maksimale mengden den er i stand til å oppløse (dens løselighet), er det en fortynnet løsning;
2) Hvis mengden oppløst stoff er nøyaktig samme mengde som oppløseligheten, er den mettet;
3) Hvis det er mer løsemiddel enn det som er i stand til å oppløses, skilles det overskytende løsemidlet fra løsningen.
Hvis denne separasjonsprosessen inkluderer krystallisering, danner den et bunnfall. Nedbør reduserer konsentrasjonen av det oppløste stoffet til metning for å øke stabiliteten i løsningen..
Følgende er løselighetsregler for vanlige ioniske faste stoffer. Hvis to regler ser ut til å være i strid med hverandre, har den foregående forrang.
1- Salter som inneholder Gruppe I-elementer (Li+, Na+, K+, Cs+, Rb+) er oppløselige. Det er få unntak fra denne regelen. Salter som inneholder ammoniumionet (NH4+) er også oppløselige.
2- Salter som inneholder nitrat (NO3-) er generelt oppløselige.
3- Saltene som inneholder Cl -, Br - eller I - er generelt oppløselige. Viktige unntak fra denne regelen er halogenidsaltene til Ag+, Pb2+ og (Hg2)to+. Dermed AgCl, PbBrto og HgtoClto de er uoppløselige.
4- De fleste av sølvsaltene er uoppløselige. AgNO3 og Ag (CtoH3ELLERto) er vanlige oppløselige salter av sølv; Så å si alle andre er uoppløselige.
5- De fleste sulfatsaltene er oppløselige. Viktige unntak fra denne regelen inkluderer CaSO4, Baso4, PbSO4, AgtoSO4 og SrSO4.
6- De fleste hydroksidsalter er bare lett oppløselige. Hydroksidsalter av gruppe I-elementer er løselige. Hydroksidsalter av gruppe II-elementer (Ca, Sr og Ba) er lett oppløselige.
Hydroksidsaltene av overgangsmetaller og Al3 + de er uoppløselige. Dermed er Fe (OH)3, Al (OH)3, Co (OH)to de er ikke løselige.
7- De fleste overgangsmetallsulfider er svært uoppløselige, inkludert CdS, FeS, ZnS og AgtoS. Arsen, antimon, vismut og bly sulfider er også uoppløselige.
8- Karbonater er ofte uoppløselige. Gruppe II karbonater (CaCO3, SrCO3 og BaCO3) er uoppløselige, i likhet med FeCO3 og PbCO3.
9- Kromater er ofte uoppløselige. Eksempler inkluderer PbCrO4 og BaCrO4.
10- Fosfater som Ca3(PO4)to og Ag3PO4 er ofte uoppløselige.
11- Fluorider som BaFto, MgFto og PbFto er ofte uoppløselige.
Eksempler på løselighet i vandige oppløsninger
Cola, saltvann, regn, syreløsninger, baseløsninger og saltløsninger er eksempler på vandige løsninger. Når du har en vandig løsning, kan du indusere et bunnfall ved utfellingsreaksjoner.
Nedbørsreaksjoner blir noen ganger kalt "dobbel forskyvning" -reaksjoner. For å bestemme om det vil dannes et bunnfall når vandige løsninger av to forbindelser blandes:
- Registrer alle ioner i løsningen.
- Kombiner dem (kation og anion) for å få alle potensielle bunnfall.
- Bruk løselighetsreglene for å bestemme hvilken (hvis noen) kombinasjon (er) som er uoppløselig og vil utfelle.
Eksempel 1: Hva skjer når Ba (NO3)to (En q) og NatoCO3 (aq)?
Ioner til stede i løsning: Bato+, IKKE3-, Na+, CO3to-
Potensielle bunnfall: BaCO3, NaNO3
Løselighetsregler: BaCO3 er uoppløselig (regel 5), NaNO3 er løselig (regel 1).
Komplett kjemisk ligning:
Bad3)to(aq) + NatoCO3(aq) ”BaCO3(s) + 2NaNO3 (En q)
Netto ionisk ligning:
Bato+(En q) + CO3to-(En q) ”BaCO3 (r)
Eksempel 2: Hva skjer når Pb (NO3)to (aq) og NH4Jeg (aq)?
Ioner til stede i løsning: Pbto+, IKKE3-, NH4+, Jeg-
Potensielle utfellinger: PbIto, NH4IKKE3
Løselighetsregler: PbIto er uoppløselig (regel 3), NH4IKKE3 er løselig (regel 1).
Komplett kjemisk ligning: Pb (NO3)2 (aq) + 2NH4Jeg(En q) ”PbI2 (r) + 2NH4IKKE3 (aq)
Netto ionisk ligning: Pbto+(En q) + 2I-(En q) ”PbI2 (r).
Referanser
- Anne Marie Helmenstine. (2017, 10. mai). Vandig definisjon (vandig løsning). Gjenopprettet fra thoughtco.com.
- Anne Marie Helmenstine. (2017, 14. mai). Vannløsningsdefinisjon i kjemi. Gjenopprettet fra thoughtco.com.
- Antoinette Mursa, K. W. (2017, 14. mai). Løselighetsregler. Gjenopprettet fra chem.libretexts.org.
- Vandige løsninger. (S.F.). Gjenopprettet fra saylordotorg.github.io.
- Berkey, M. (2011, 11. november). Vandige løsninger: definisjon og eksempler. Gjenopprettet fra youtube.com.
- Reaksjoner i vandig løsning. (S.F.). Gjenopprettet fra chemistry.bd.psu.edu.
- Reid, D. (S.F.). Vandig løsning: Definisjon, reaksjon og eksempel. Gjenopprettet fra study.com.
- Løselighet. (S.F.). Gjenopprettet fra chemed.chem.purdue.edu.


Ingen har kommentert denne artikkelen ennå.