
Hva er dipoldipolkrefter?
De dipol dipol krefter eller Keesom-krefter er de intermolekylære interaksjoner som er tilstede i molekyler med permanente dipolmomenter. Det er en av Van der Waals-kreftene, og selv om den er langt fra den sterkeste, er den en nøkkelfaktor som forklarer de fysiske egenskapene til mange forbindelser..
Uttrykket "dipol" refererer eksplisitt til to poler: en negativ og en positiv. Dermed snakker vi om dipolare molekyler når de har definerte områder med høy og lav elektrontetthet, noe som bare er mulig hvis elektronene "migrerer" fortrinnsvis til visse atomer: de mest elektronegative..
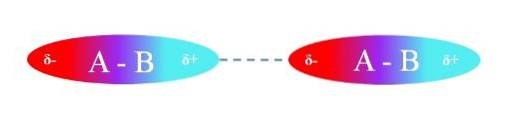
Det øvre bildet illustrerer dipol-dipol-interaksjoner mellom to A-B-molekyler med permanente dipolmomenter. På samme måte kan det observeres hvordan molekylene er orientert slik at interaksjonene er effektive. Dermed tiltrekker den positive regionen δ + den negative regionen δ-.
I henhold til ovenstående kan det spesifiseres at disse typer interaksjoner er retningsbestemte (i motsetning til ioniske ladning-ladningsinteraksjoner). Molekylene i sitt miljø orienterer polene sine på en slik måte at, selv om de er svake, gir summen av alle disse interaksjonene forbindelsen stor intermolekylær stabilitet..
Dette resulterer i at forbindelser (organiske eller uorganiske) som er i stand til å danne dipol-dipol-interaksjoner, har høye kokepunkter eller smeltepunkter..
Artikkelindeks
- 1 Dipole øyeblikk
- 1.1 Symmetri
- 1.2 Asymmetri i ikke-lineære molekyler
- 2 Orienteringer av dipolene
- 3 Interaksjoner med hydrogenbindinger
- 4 Referanser
Dipole øyeblikk
Dipolmomentet µ av et molekyl er en vektormengde. Med andre ord: det avhenger av retningene hvor det er en polaritetsgradient. Hvordan og hvorfor kommer denne gradienten? Svaret ligger i bindingen og i den indre naturen til elementene i elementene..
I det øvre bildet er A for eksempel mer elektronegativ enn B, så i A-B-bindingen er den høyeste elektrondensiteten plassert rundt A.
På den annen side "gir B" opp sin elektronsky og er derfor omgitt av en elektronfattig region. Denne forskjellen i elektronegativiteter mellom A og B skaper polaritetsgradienten.
Ettersom den ene regionen er rik på elektroner (δ-) mens den andre er fattig på elektroner (δ +), vises de to polene, som avhengig av avstandene mellom dem har forskjellige størrelser på µ, som er bestemt for hver forbindelse.
Symmetri
Hvis et molekyl av en bestemt forbindelse har µ = 0, sies det å være et apolært molekyl (selv om det har polaritetsgradienter).
For å forstå hvordan symmetri - og derfor molekylær geometri - spiller en viktig rolle i denne parameteren, er det nødvendig å vurdere AB-bindingen igjen..
På grunn av forskjellen i elektronegativiteter er det definerte regioner som er rike og fattige i elektroner.
Hva om lenkene var A-A eller B-B? I disse molekylene ville det ikke være noe dipolmoment, siden begge atomer tiltrekker seg mot dem på samme måte som elektronene til bindingen (hundre prosent kovalent binding).
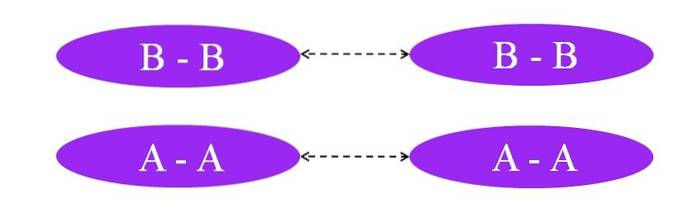
Som det kan sees på bildet, er det verken i molekyl A-A eller i molekyl BB nå regioner som er rike eller fattige i elektroner (rød og blå). Her er en annen type styrke ansvarlig for å holde sammen Ato og Bto: induserte dipol-dipol-interaksjoner, også kjent som London-krefter eller spredningskrefter.
Tvert imot, hvis molekylene var av AOA- eller BOB-typen, ville det være frastøt mellom polene deres fordi de har like ladninger:
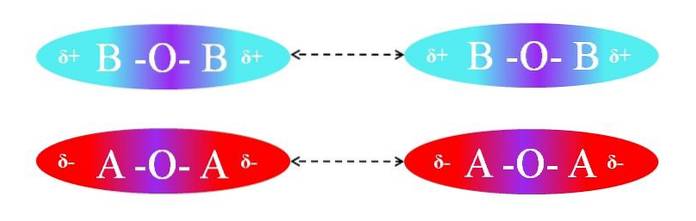
Δ + -regionene til to BOB-molekyler tillater ikke effektiv dipol-dipol-interaksjon; det samme gjelder for δ- regionene til de to AOA-molekylene. På samme måte har begge molekylparene µ = 0. O-A-polaritetsgradienten kanselleres vektorelt med den for A-O-bindingen.
Følgelig kommer også dispersjonskrefter i spill i AOA- og BOB-paret på grunn av fraværet av en effektiv orientering av dipolene.
Asymmetri i ikke-lineære molekyler
Det enkleste tilfellet er CF-molekylet4 (eller skriv CX4). Her har C en tetrahedral molekylær geometri, og elektronrike regioner er i toppunktene, spesielt på de elektronegative atomer av F.
Polaritetsgradienten C-F avbrytes i en hvilken som helst retning av tetraedronet, og forårsaker vektorsummen av alle disse til å være lik 0.
Selv om tetraederens sentrum er veldig positivt (δ +) og dets hjørner veldig negativt (δ-), kan dette molekylet ikke danne dipol-dipolinteraksjoner med andre molekyler..
Orientering av dipolene
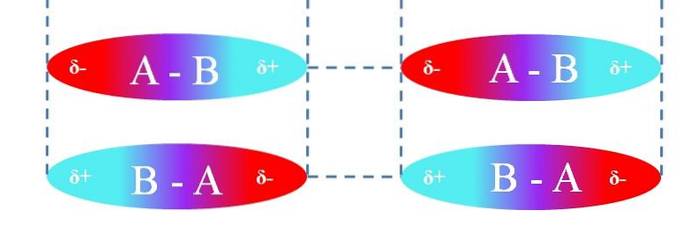
Når det gjelder lineære A-B-molekyler, er de orientert på en slik måte at de danner de mest effektive dipol-dipol-interaksjonene (som kan sees på bildet ovenfor). Ovennevnte gjelder på samme måte for andre molekylære geometrier; for eksempel de vinklede når det gjelder NO-molekylerto.
Dermed bestemmer disse interaksjonene om forbindelse A-B er en gass, en væske eller et fast stoff ved romtemperatur..
For forbindelser Ato og Bto (de av de lilla ellipsene), er det veldig sannsynlig at de er gassformede. Imidlertid, hvis atomene er veldig klumpete og lett polariserbare (noe som øker Londons krefter), så kan begge forbindelsene være enten faste eller flytende..
Jo sterkere dipol-dipol-interaksjoner, jo større er kohesjonen mellom molekylene; på samme måte, jo høyere er smelte- og kokepunktene til forbindelsen. Dette er fordi det er behov for høyere temperaturer for å "bryte" disse interaksjonene..
På den annen side fører en økning i temperatur til at molekylene vibrerer, roterer og beveger seg oftere. Denne "molekylære agitasjonen" forringer retningene til dipolene, og derfor blir de intermolekylære kreftene i forbindelsen svekket..
Interaksjoner med hydrogenbindinger
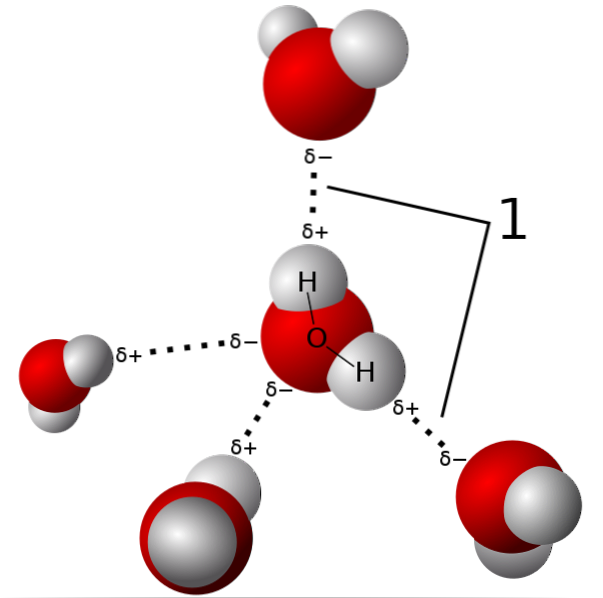
På bildet over vises fem vannmolekyler som vekselvirker av hydrogenbindinger. Dette er en spesiell type dipol-dipol-interaksjoner. Den elektronfattige regionen er okkupert av H; og regionen rik på elektroner (δ-) er okkupert av de høyelektronegative atomene N, O og F.
Det vil si at molekyler med N-, O- og F-atomer bundet til H kan danne hydrogenbindinger..
Dermed er hydrogenbindinger O-H-O, N-H-N og F-H-F, O-H-N, N-H-O, etc. Disse molekylene har permanente og veldig intense dipolmomenter, som orienterer dem riktig for å "utnytte" disse broene..
De er energisk svakere enn noen kovalent eller ionisk binding. Selv om summen av alle hydrogenbindinger i fasen av en forbindelse (fast, flytende eller gassformig) gjør at den har egenskaper som definerer den som unik..
For eksempel er dette tilfellet med vann, hvis hydrogenbindinger er ansvarlige for dets høye kokepunkt og for å være mindre tette i istilstand enn flytende vann; grunnen til at isfjell flyter i havet.
Referanser
- Dipole-Dipole styrker. Hentet 30. mai 2018 fra: chem.purdue.edu
- Grenseløs læring. Dipole-Dipole Force. Hentet 30. mai 2018 fra: courses.lumenlearning.com
- Jennifer Roushar. (2016). Dipole-Dipole styrker. Hentet 30. mai 2018 fra: sophia.org
- Helmenstine, Anne Marie, Ph.D. (3. mai 2018). Hva er eksempler på hydrogenbinding? Hentet 30. mai 2018 fra: thoughtco.com
- Mathews, C. K., Van Holde, K.E. og Ahern, K.G. (2002) Biokjemi. Tredje utgave. Addison Wesley Longman, Inc., P 33.
- Whitten, Davis, Peck & Stanley. Kjemi. (8. utg.). CENGAGE Learning, s 450-452.
- Bruker Qwerter. (16. april 2011). 3D-modell hydrogenbindinger i toalett. [Figur]. Hentet 30. mai 2018 fra: commons.wikimedia.org

Ingen har kommentert denne artikkelen ennå.