
Hva er undernivåer for energi, og hvordan blir de representert?

De undernivåer for energi i atomet er de måten elektronene er organisert i de elektroniske skallene, deres distribusjon i molekylet eller atomet. Disse energinivåene kalles orbitaler..
Organiseringen av elektroner i undernivåer er det som tillater kjemiske kombinasjoner av forskjellige atomer og definerer også deres posisjon i det periodiske elementet..
Elektroner er ordnet i atomens elektroniske skall på en bestemt måte ved en kombinasjon av kvantetilstander. For øyeblikket når en av disse tilstandene er okkupert av et elektron, må de andre elektronene være plassert i en annen tilstand.
Artikkelindeks
- 1. Introduksjon
- 2 Plassering i det periodiske elementet
- 3 Elektronens plassering i orbitalene
- 4 Spesielle elektroniske konfigurasjoner
- 5 Referanser
Introduksjon
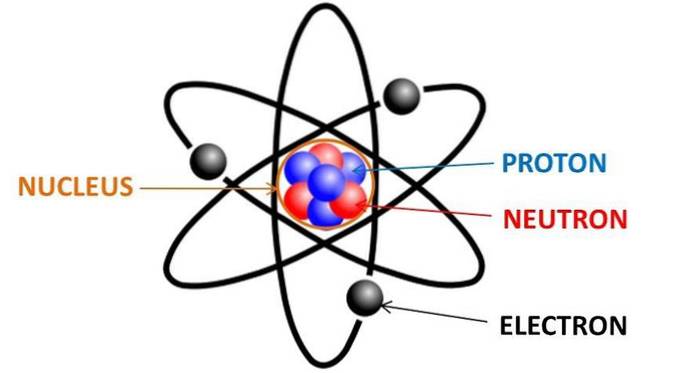
Hvert kjemisk element i det periodiske systemet består av atomer, som igjen består av nøytroner, protoner og elektroner. Elektroner er negativt ladede partikler som finnes rundt kjernen til ethvert atom, fordelt i elektronenes orbitaler.
Elektronorbitaler er volumet på rommet der et elektron har 95% sjanse for å møte. Det er forskjellige typer orbitaler, med forskjellige former. Maksimalt to elektroner kan være plassert i hver bane. Den første bane i et atom er der det er størst sannsynlighet for å finne elektroner.
Orbitalene er betegnet med bokstavene s, p, d og f, det vil si Sharp, Principle, Diffuse og Fundamental, og de kombineres når atomer går sammen for å danne et større molekyl. I hvert lag av atomet er disse kombinasjonene av orbitaler.
For eksempel, i lag 1 av atomet er det S-orbitaler, i lag 2 er det S og P-orbitaler, i lag 3 av atomet er det S, P og D-orbitaler og til slutt i lag 4 av atomet er det alle S-, P-, D- og F-orbitalene.
Også i orbitalene finner vi forskjellige undernivåer, som igjen kan lagre flere elektroner. Orbitaler på forskjellige energinivå ligner hverandre, men opptar forskjellige områder i rommet..
Den første orbitalen og den andre orbitalen har de samme egenskapene som en S-orbital, de har radiale noder, de har større sannsynlighet for sfærisk volum, og de kan bare holde to elektroner. Imidlertid ligger de på forskjellige energinivåer og opptar dermed forskjellige rom rundt kjernen..
Plassering på det periodiske elementet
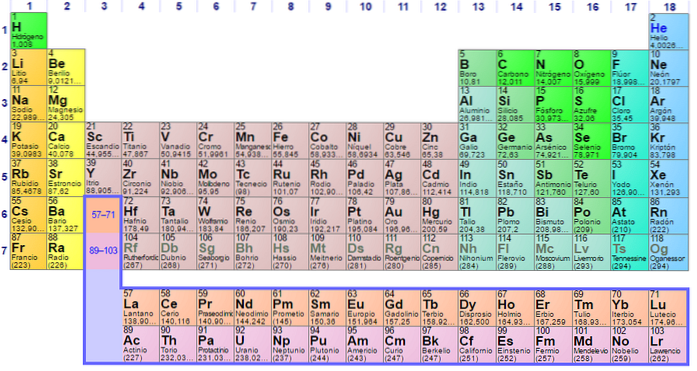
Hver av de elektroniske konfigurasjonene av elementene er unike, og derfor bestemmer de sin posisjon i det periodiske elementet. Denne posisjonen er definert av perioden for hvert element og dets atomnummer av antall elektroner som elementets atom har..
Dermed er det viktig å bruke det periodiske systemet for å bestemme konfigurasjonen av elektroner i atomer. Elementene er delt inn i grupper i henhold til deres elektroniske konfigurasjoner som følger:
Hver bane er representert i spesifikke blokker innenfor det periodiske elementet. For eksempel er blokken av S-orbitaler regionen til alkalimetallene, den første gruppen i tabellen og hvor seks grunnstoffer er funnet Litium (Li), Rubidium (Rb), Kalium (K), Sodium (Na), Francium ( Fr) og Cesium (Cs) og også hydrogen (H), som ikke er et metall, men en gass.
Denne gruppen av elementer har et elektron som lett går tapt for å danne et positivt ladet ion. De er de mest aktive metaller og de mest reaktive.
Hydrogen, i dette tilfellet, er en gass, men det er innenfor gruppe 1 i det periodiske elementet, siden det også bare har ett elektron. Hydrogen kan danne ioner med en enkelt positiv ladning, men å trekke ut enkeltelektronet krever mye mer energi enn å fjerne elektroner fra de andre alkalimetallene. Når det dannes forbindelser, genererer hydrogen vanligvis kovalente bindinger.
Imidlertid blir hydrogen under ekstremt høyt trykk metallisk og oppfører seg som resten av elementene i gruppen. Dette skjer for eksempel inne i kjernen til planeten Jupiter.
Gruppe 2 tilsvarer jordalkalimetallene, siden oksidene har alkaliske egenskaper. Blant elementene i denne gruppen finner vi magnesium (Mg) og kalsium (Ca). Orbitalene deres tilhører også S-nivået.
Overgangsmetallene, som tilsvarer gruppe 3 til 12 i det periodiske systemet, har orbitaler av D-typen..
Elementene som går fra gruppe 13 til 18 i tabellen tilsvarer orbitaler P. Og til slutt har elementene kjent som lantanider og aktinider orbitaler kalt F.
Elektron plassering i orbitaler
Elektroner finnes i atomets orbitaler som en måte å senke energi på. Derfor, hvis de søker å øke energi, vil elektronene fylle de viktigste orbitalnivåene og bevege seg bort fra atomkjernen..
Det må vurderes at elektroner har en egen egenskap kjent som spinn. Dette er et kvantebegrep som blant annet bestemmer elektronets rotasjon i bane. Hva er viktig for å bestemme din posisjon i energinivåene.
Reglene som bestemmer posisjonen til elektronene i atomets orbitaler er følgende:
- Aufbau's prinsipp: Elektroner kommer inn i de laveste energi orbitalene først. Dette prinsippet er basert på diagrammer over energinivåene til visse atomer.
- Prinsipp for utelukkelse av Pauli: En atombane kan beskrive minst to elektroner. Dette betyr at bare to elektroner med forskjellige elektronspinn kan okkupere en atombane..
Dette innebærer at en atombane er en energitilstand.
- Hunds regel: Når elektronene opptar orbitaler med samme energi, vil elektronene komme inn i de første tomme orbitalene. Dette betyr at elektroner foretrekker parallelle spinn i separate baner av energinivåene..
Elektronene vil fylle alle orbitalene i undernivåene før de møter motsatte spinn.
Spesielle elektroniske konfigurasjoner
Det er også atomer med spesielle tilfeller av energiundernivåer. Når to elektroner okkuperer samme bane, må de ikke bare ha forskjellige spinn (som indikert av Pauli-eksklusjonsprinsippet), men koblingen av elektronene øker energien litt..
Når det gjelder energinivåer, reduserer halvfull og full full undernivå energien til atomet. Dette fører til at atomet har større stabilitet.
Referanser
- Elektronkonfigurasjon. Gjenopprettet fra Wikipedia.com.
- Introduksjon av elektroniske konfigurasjoner. Gjenopprettet fra chem.libretexts.org.
- Orbitaler og obligasjoner. Gjenopprettet fra chem.fsu.edu.
- Periodisk tabell, hovedgruppeelementer. Gjenopprettet fra newworldencyclopedia.org.
- Prinsipper for elektrokonfigurasjon. Gjenopprettet fra sartep.com.
- Elektronisk konfigurering av elementer. Gjenopprettet fra science.uwaterloo.ca.
- Elektron spinn. Gjenopprettet fra hyperphysics.phy-astr.gsu.edu.



Ingen har kommentert denne artikkelen ennå.